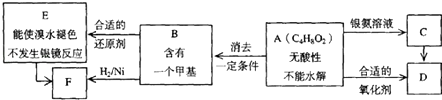
题目内容
【题目】实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4的主要流程如下: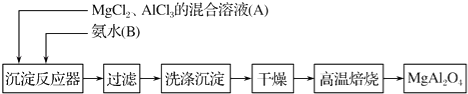
(1)制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式为 .
(2)判断流程中沉淀是否洗净所用的试剂是 .
(3)在25℃下,向浓度均为0.01mol/L的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式: .
【已知25℃时Ksp[Mg(OH)2]=1.8×10﹣11 , Ksp[Al(OH)3]=3×10﹣34】
(4)将Mg、Al组成的9.9g混合物投入一定量稀硝酸中,恰好完全反应,共收集到还原产物NO气体6.72L(标准状况),向反应后的溶液中加入4mol/L的Na0H溶液300mL时,则形成沉淀的质量为g.
【答案】
(1)2Al(OH)3+Mg(OH)2=MgAl2O4+4H2O
(2)AgNO3溶液(或硝酸酸化的AgNO3溶液)
(3)Al(OH)3,Al3++3NH3?H2O=Al(OH)3↓+3NH4+
(4)17.4
【解析】解:(1)经分析沉淀为Al(OH)3和Mg(OH)2,高温焙烧备MgAl2O4时发生反应生成MgAl2O4和H2O,反应的化学方程式为:2Al(OH)3+Mg(OH)2 ![]() MgAl2O4+4H2O;
MgAl2O4+4H2O;
(2)沉淀中应该附着氯离子和铵根离子,若判断是否洗净:可以取少量最后一次洗涤液,加入AgNO3溶液(或硝酸酸化的AgNO3溶液)溶液进行判断,若生成白色沉淀,则说明没有洗涤干净,若没有白色沉淀生成,则说明已经洗涤干净;
(3)向0.01molL﹣1的MgCl2中逐滴加入氨水,Ksp[Mg(OH)2]=c(Mg2+)[c(OH﹣)]2=0.01molL﹣1×[c(OH﹣)]2=1.8×10﹣11,c(OH﹣)= ![]() ×10﹣5,即当溶液中c(OH﹣)>
×10﹣5,即当溶液中c(OH﹣)> ![]() ×10﹣5时有Mg(OH)2沉淀生成;
×10﹣5时有Mg(OH)2沉淀生成;
向0.01molL﹣1AlCl3溶液中逐滴加入氨水,Ksp[Al(OH)3]=c(Al3+)[c(OH﹣)]3=0.01molL﹣1×[c(OH﹣)]3=3×10﹣34,c(OH﹣)= ![]() ×10﹣11,即当溶液中c(OH﹣)>
×10﹣11,即当溶液中c(OH﹣)> ![]() ×10﹣11时有Al(OH)3沉淀生成;向浓度均为0.01molL﹣1的MgCl2和AlCl3混合溶液中逐滴加入氨水,应先生成Al(OH)3沉淀,反应离子方程式应为:Al3++3NH3H2O=Al(OH)3↓+3NH4+;
×10﹣11时有Al(OH)3沉淀生成;向浓度均为0.01molL﹣1的MgCl2和AlCl3混合溶液中逐滴加入氨水,应先生成Al(OH)3沉淀,反应离子方程式应为:Al3++3NH3H2O=Al(OH)3↓+3NH4+;
(4)硝酸被还原为NO气体且标准状况下体积为6.72L,物质的量为: ![]() =0.3mol,所以转移的电子的物质的量为:0.3mol×(5﹣2)=0.9mol,设金属Mg、Al组成的9.9g混合物中MgAl物质的量分别为:x、y,
=0.3mol,所以转移的电子的物质的量为:0.3mol×(5﹣2)=0.9mol,设金属Mg、Al组成的9.9g混合物中MgAl物质的量分别为:x、y,
2x+3y=0.9
24x+27y=9.9
x=0.3mol
y=0.1mol
向反应后的溶液中加入4mol/L的Na0H溶液300mL.n(OH﹣)=0.3L×4mol/L=1.2mol,
Mg2++ | 2OH﹣=Mg(OH)2↓ |
1 | 2 |
0.3mol | 0.6mol |
Al3++ | 3OH﹣= | Al(OH)3↓ |
1 | 3 | 1 |
0.1mol | 0.3mol | 0.1mol |
剩余氢氧化钠物质的量=1.2mol﹣0.9mol=0.3mol,
Al(OH)3+ | OH﹣=AlO2﹣+2H2O |
0.1mol | 0.1mol |
最后沉淀为Mg(OH)2,所以最后沉淀质量为:0.3mol×58g/mol=17.4g,
所以答案是:(1)2Al(OH)3+Mg(OH)2=MgAl2O4+4H2O;(2)AgNO3溶液(或硝酸酸化的AgNO3溶液);(3)Al(OH)3;Al3++3NH3H2O=Al(OH)3↓+3NH4+;(4)17.4