题目内容
【题目】亚硝酸钠(NaNO2)是一种常见的食品添加剂。某兴趣小组用如图所示装置制备NaNO2并对其性质作如下探究(A中加热装置已略去)。

查阅资料可知:
①2NO+Na2O2=2NaNO2;2NO2+Na2O2 =2NaNO3。
②NO能被酸性KMnO4氧化成NO3-。
(1)装置中仪器a的名称为____________。A中反应的化学方程式_____________。
(2)装置B中观察到的主要现象______________。
(3)装置C中盛放的试剂是______________。
(4)装置E的作用是______________。
(5)A中滴入浓硝酸之前,应先通入N2一段时间,原因是____________。
(6)写出NO被酸性KMnO4氧化的离子反应方程式______________。
【答案】 分液漏斗 C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O 溶液变蓝,铜片溶解,有无色气体冒出 碱石灰(或生石灰或氢氧化钠固体) 吸收有毒气体NO,防止空气污染 排尽装置中的空气,防止对后续实验有干扰 5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O
CO2↑+4NO2↑+2H2O 溶液变蓝,铜片溶解,有无色气体冒出 碱石灰(或生石灰或氢氧化钠固体) 吸收有毒气体NO,防止空气污染 排尽装置中的空气,防止对后续实验有干扰 5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O
【解析】制备NaNO2并对其性质作探究,由实验装置可知A中发生C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O,B中吸收挥发的硝酸和生成的二氧化氮,C中固体干燥剂干燥NO,并除去可能混有的酸雾,D中发生2NO+Na2O2=2NaNO2,E中高锰酸钾吸收尾气NO,据此分析解答。
CO2↑+4NO2↑+2H2O,B中吸收挥发的硝酸和生成的二氧化氮,C中固体干燥剂干燥NO,并除去可能混有的酸雾,D中发生2NO+Na2O2=2NaNO2,E中高锰酸钾吸收尾气NO,据此分析解答。
(1)根据仪器构造可知装置中仪器a的名称为分液漏斗。A中是碳和浓硝酸发生的反应生成二氧化碳、二氧化氮和水,化学方程式为C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;
(2)B装置中的水将NO2转化为NO,铜与稀硝酸反应生成NO,所以装置B中观察到的主要现象是溶液变蓝,铜片溶解,有无色气体冒出;
(3)装置C中盛放的试剂用来干燥NO,所以盛放的试剂是碱石灰(或生石灰或氢氧化钠固体)等;
(4)由信息可知,E装置的作用是利用高锰酸钾溶液的强氧化性氧化吸收有毒气体一氧化氮气体,防止空气污染;
(5)由于装置中含有空气,NO易被氧化为NO2,所以A中滴入浓硝酸之前,应先通入N2一段时间的目的是排尽装置中的空气,防止对后续实验有干扰;
(6)NO被酸性KMnO4氧化为硝酸根离子,氮元素化合价从+2价升高到+5价,失去3个电子,Mn元素化合价从+7价降低到+2价,得到5个电子,则根据电子得失守恒、电荷守恒以及原子守恒可知反应的离子反应方程式为5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O。

 名校课堂系列答案
名校课堂系列答案【题目】作为工业生产的催化剂和制备纳米MgO的材料,草酸镁(MgC2O4·2H2O)有着广阔的应用和发展前景。回答下列问题:
(1)MgC2O4·2H2O的制备

已知氯化镁、草酸铵、草酸镁在水中的溶解度如下表:
氯化镁 | 草酸铵 | 草酸镁 | |
20℃ | 54.6g | 4.45g | 微溶 |
70℃ | 61.0g | 22.4g | |
100℃ | 73.3g | 34.7g |
实验方法:(i)加热煮沸蒸馏水,取300mL冷却至70℃,加140g MgCl2·6H2O,此制MgCl2溶液;
(ii)按照图示装置装好药品,连接好装置;
(iii)在磁力加热搅拌的情况下,缓缓滴入饱和(NH4)2C2O4溶液,并水浴加热,直至不再产生白色沉淀为止;
(iv)分离沉淀、洗涤,得MgC2O4·2H2O晶体。
①装置中仪器甲的名称是_____,其冷水进水口为_____填“a”或“b”)。
②仪器乙中c部位的作用是____________________。
③检验产品洗涤干净的方法是________________。
(2)MgC2O4·2H2O分解产物的探究
利用下图所示装置探究MgC2O4·2H2O分解产物CO、CO2 等的性质。
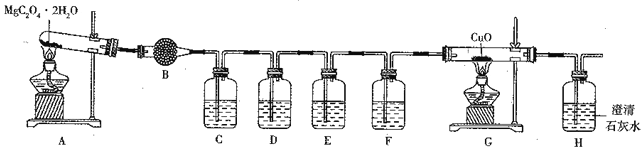
①A中发生反应的化学方程式为______________________。
②装置B中盛装的药品是_____,装置C的作用是______,装置D中的试剂是______,装置G中的现象是____________________。

