题目内容
【题目】铬铁矿的主要成分可表示为FeOCr2O3 , 还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钠(Na2Cr2O7)的过程如图所示: 
已知:①NaFeO2在水溶液中强烈水解生成对应的氢氧化物.
②2CrO ![]() +2H+Cr2O
+2H+Cr2O ![]() +H2O
+H2O
(1)完成煅烧过程中铬铁矿发生的主要反应的化学方程式:
FeOCr2O3+7O2+ ![]() Na2CrO4+NaFeO2+
Na2CrO4+NaFeO2+
上述反应中每熔化1mol FeOCr2O3 , 转移的电子数为
(2)浸出液的成分除Na2CrO4、NaOH外,还含有(写化学式,下同),滤渣1的成分是 .
(3)调节浸出液pH所加的试剂a是(写化学式).
(4)该流程中用了两步调节pH,若合并成一步调pH,酸性过强,产品Na2Cr2O7晶体中可能含有较多杂质,用离子方程式说明引入该杂质的原因 .
(5)100kg铬铁矿(含FeOCr2O3 89.6%)最多可获得Na2Cr2O72H2O的质量为kg.
【答案】
(1)4;20NaOH;8;4;10H2O;4.214×1024
(2)Na2SiO3、NaAlO2;Fe(OH)3
(3)H2SO4
(4)AlO2﹣+4H+=Al3++2H2O
(5)119.2
【解析】解:(1.)通过以上分析知,“焙烧”后的固体产物成分除Na2CrO4、NaFeO2外,还有NaAlO2、Na2SiO3 , 铬元素化合价+3价,铁元素化合价为+2价,被氧气氧化生成铬酸钠和NaFeO2 , 铬元素化合价变化为+6价,铁元素化合价变化为+3价,电子转移总数为34,据此电子守恒和原子守恒配平书写得到焙烧过程中发生的氧化还原反应为4FeOCr2O3+7O2+20NaOH ![]() 8Na2CrO4+4NaFeO2+10H2O,4FeOCr2O3反应电子转移28,每熔化1mol FeOCr2O3 , 转移的电子数为
8Na2CrO4+4NaFeO2+10H2O,4FeOCr2O3反应电子转移28,每熔化1mol FeOCr2O3 , 转移的电子数为 ![]() mol×6.02×1023=4.214×1024 ,
mol×6.02×1023=4.214×1024 ,
所以答案是:4FeOCr2O3+7O2+10Na2CO3 ![]() 8Na2CrO4+4NaFeO2+10CO2;4.214×1024;
8Na2CrO4+4NaFeO2+10CO2;4.214×1024;
(2.)浸出液中溶质是Na2CrO4、NaAlO2、NaOH、Na2SiO3 , 浸出液的成分除Na2CrO4、NaOH外,还含有NaAlO2、Na2SiO3 , NaFeO2在水溶液中强烈水解生成对应的氢氧化物,所以滤渣1为Fe(OH)3 , 所以答案是:NaAlO2、Na2SiO3;Fe(OH)3;
(3.)由分析可知,流程最后分离得到硫酸钠,加入的试剂a为硫酸,用来调节溶液PH,所以答案是:H2SO4 ;
(4.)该流程中用了两步调节pH,若合并成一步调pH,酸性过强,产品Na2Cr2O7晶体中可能含有较多杂质,可能含有铝离子,偏铝酸钠和适量硫酸反应生成氢氧化铝沉淀,氢氧化铝会溶解于氢氧化铝生成铝离子,AlO2﹣+H++H2O=Al(OH)3 , Al(OH)3+3H+=Al3++H2O,引入该杂质的原因用离子方程式说明为:AlO2﹣+4H+=Al3++2H2O或AlO2﹣+H++H2O=Al(OH)3 , Al(OH)3+3H+=Al3++H2O,
所以答案是:AlO2﹣+4H+=Al3++2H2O或AlO2﹣+H++H2O=Al(OH)3 , Al(OH)3+3H+=Al3++H2O;(5.)100kg铬铁矿(含FeOCr2O3 89.6%)含FeOCr2O3物质的量= ![]() =400mol,结合铬元素守恒,获得Na2Cr2O72H2O的物质的量也为400mol,最多可获得Na2Cr2O72H2O的质量400mol×298g/mol=119200g=119.2kg,
=400mol,结合铬元素守恒,获得Na2Cr2O72H2O的物质的量也为400mol,最多可获得Na2Cr2O72H2O的质量400mol×298g/mol=119200g=119.2kg,
所以答案是:119.2.

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案【题目】定量分析是化学实验中重要的组成部分. Ⅰ.中和热的测定:
(1)在实验室中,用50mL 0.40mol/L的盐酸与50mL 0.50mol/L的NaOH溶液反应测定和热.假设此时溶液密度均为1g/cm3 , 生成溶液的比容热c=4.18J/(g℃),实验起始温度为T1℃,终止温度为T2℃,请写出中和热的计算式 (写出最后结果)△H=KJ/mol.
(2)1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6kJ的热量.请写出表示该反应中和热的热化学方程式 .
(3)滴定原理为:(用离子方程式表示).
(4)滴定时,KMnO4溶液应装在(填“酸式”或“碱式”)滴定管中,达到滴定终点时的颜色变化为 .
(5)如图表示50mL滴定管中液面的位置,此时滴定管中液面的读数为mL. 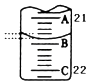
(6)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如表:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 26.32 | 24.02 | 23.98 |
从上表可以看出,第一次实验中记录消耗KMnO4溶液的体积明显多于后两次,其原因可能是
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积
B.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,后两次均用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
(7)写出计算H2C2O4的物质的量浓度的最简表达式:C=mol/L.
【题目】下表各组物质中,物质之间不可能实现如图 ![]() 所示转化的是( )
所示转化的是( )
选项 | X | Y | Z | M |
A | Fe(s) | FeCl2 | FeCl3 | Cl2 |
B | NaOH(aq) | Na2CO3 | NaHCO3 | CO2 |
C | NH3(g) | NO | NO2 | O2 |
D | S(s) | SO2 | SO3 | O2 |
A.A
B.B
C.C
D.D
