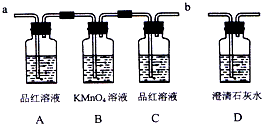
题目内容
某化学兴趣小组,通过右图装置进行硫酸与铜反应的实验探究.
(1)提出假设:
假设一:加热时,稀H2SO4与Cu能反应.
假设二:加热时,浓H2SO4与Cu能反应.
(2)设计实验:
实验前,试管B盛放的是______溶液(填“品红”或“酚酞”).
(3)实验结论:通过以上实验,说明浓硫酸具有______(填写字母代号).
A.强氧化性B.脱水性C.吸水性
(4)问题与计论:
①有同学认为该装置不完善,Cu与浓H2SO4反应生成了一种大气污染物,该气体是______;他建议在试管B口塞一团棉花,该棉花最好浸泡下列哪种溶液______(填字母编号);
A.稀盐酸B.NaOH溶液C.NaCl溶液
②该兴趣小组在探究Cu与浓H2SO4反应时,将质量5.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余3.4g,将试管A中液体稀释成100ml溶液.该溶液中Cu2+物质的量浓度为______mol?L-1.
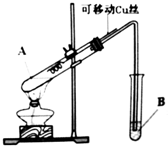
(1)提出假设:
假设一:加热时,稀H2SO4与Cu能反应.
假设二:加热时,浓H2SO4与Cu能反应.
(2)设计实验:
| 实验编号 | 实验操作 | 实验现象 |
| 1 | 将Cu丝与稀H2SO4接触,加热 | 试管B中溶液无明显变化 |
| 2 | 将Cu丝与浓H2SO4接触,加热 | 试管B中溶液褪色 |
(3)实验结论:通过以上实验,说明浓硫酸具有______(填写字母代号).
A.强氧化性B.脱水性C.吸水性
(4)问题与计论:
①有同学认为该装置不完善,Cu与浓H2SO4反应生成了一种大气污染物,该气体是______;他建议在试管B口塞一团棉花,该棉花最好浸泡下列哪种溶液______(填字母编号);
A.稀盐酸B.NaOH溶液C.NaCl溶液
②该兴趣小组在探究Cu与浓H2SO4反应时,将质量5.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余3.4g,将试管A中液体稀释成100ml溶液.该溶液中Cu2+物质的量浓度为______mol?L-1.

(2)试管B中的试剂用于检验是否有二氧化硫生成,用于二氧化硫具有漂白性,能够使品红溶液褪色,可以使用品红溶液检验;二氧化硫与酚酞溶液没有明显现象,不能使用酚酞,
故答案为:品红;
(3)加热时,稀硫酸不与铜反应,而浓硫酸能够与铜反应,证明了浓硫酸具有强氧化性,所以A正确,
故答案为:A;
(4)①浓硫酸与铜反应生成有毒的气体二氧化硫,应该使用尾气吸收装置;稀盐酸、氯化钠与二氧化硫不反应,无法吸收二氧化硫,氢氧化钠溶液能够与二元化反应,可以在试管B口塞一团浸有氢氧化钠溶液棉花,使用B正确,
故答案为:SO2;B;
②反应前铜为5.0g,反应后剩余3.4g铜,反应消耗了5.0g-3.4g=1.6g铜,根据质量守恒,溶液中铜离子的浓度为:
-0.25mol/L,
故答案为:0.25.
故答案为:品红;
(3)加热时,稀硫酸不与铜反应,而浓硫酸能够与铜反应,证明了浓硫酸具有强氧化性,所以A正确,
故答案为:A;
(4)①浓硫酸与铜反应生成有毒的气体二氧化硫,应该使用尾气吸收装置;稀盐酸、氯化钠与二氧化硫不反应,无法吸收二氧化硫,氢氧化钠溶液能够与二元化反应,可以在试管B口塞一团浸有氢氧化钠溶液棉花,使用B正确,
故答案为:SO2;B;
②反应前铜为5.0g,反应后剩余3.4g铜,反应消耗了5.0g-3.4g=1.6g铜,根据质量守恒,溶液中铜离子的浓度为:
| ||
| 0.1L |
故答案为:0.25.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
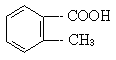 )多种同分异构体,其中属于酯类,且结构中含有苯环和甲基的同分异构体的结构简式为____、____、_____、____、_____、____(填不满,可以空着)。
)多种同分异构体,其中属于酯类,且结构中含有苯环和甲基的同分异构体的结构简式为____、____、_____、____、_____、____(填不满,可以空着)。