题目内容
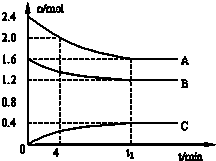
T℃时,A气体与B气体反应生成C气体,反应过程中,A、B、C浓度变化如图(I)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示.根据以上条件,回答下列问题:

(1)A与B反应生成C的化学方程式为 ,正反应为 (填“吸热”或“放热”)反应.
(2)t1min后,改变下列某一条件,能使平衡向逆反应方向移动的有 .
A.保持其他条件不变,增大压强
B.保持容器总体积不变,通入少量稀有气体
C.保持其他条件不变,升高温度
(3)T℃时,该反应化学平衡常数K= ,若将温度升高100℃时,K值将 .(填“增大”,“减小”或“不变”)

(1)A与B反应生成C的化学方程式为
(2)t1min后,改变下列某一条件,能使平衡向逆反应方向移动的有
A.保持其他条件不变,增大压强
B.保持容器总体积不变,通入少量稀有气体
C.保持其他条件不变,升高温度
(3)T℃时,该反应化学平衡常数K=
分析:(1)由图(Ⅰ)可知,A和B的物质的量浓度减小,C的物质的量浓度增加,则A、B为反应物,C为生成物,由反应的浓度的变化之比等于化学计量数之比判断反应的化学方程式;由图(Ⅱ)可知T1>T2,升高温度B的体积分数增大,说明生成温度平衡向逆反应方向移动,据此判断该反应是吸热还是放热反应;
(2)该反应为放热反应,根据压强、温度、稀有气体对反应A+3B?2C的影响进行判断;
(3)根据达到平衡时各组分的浓度及平衡常数表达式计算出T℃时该反应化学平衡常数K;根据该反应为放热反应判断温度升高100℃时K值变化.
(2)该反应为放热反应,根据压强、温度、稀有气体对反应A+3B?2C的影响进行判断;
(3)根据达到平衡时各组分的浓度及平衡常数表达式计算出T℃时该反应化学平衡常数K;根据该反应为放热反应判断温度升高100℃时K值变化.
解答:解:(1)由图(Ⅰ)可知,A和B的物质的量浓度减小,C的物质的量浓度增加,则A、B为反应物,C为生成物,由反应的浓度的变化之比等于化学计量数之比可得:△c(A):△c(B):△c(C)=0.2mol/L:0.6mol/L:0.4mol/L=1:3:2,则反应的化学方程式为:A+3B?2C;由图(Ⅱ)可知T1>T2,升高温度B的体积分数增大,说明升高温度平衡向逆反应方向移动,正反应为放热反应,
故答案为:A+3B?2C;放热;
(2)A.保持其他条件不变,增大压强,平衡向正反应方向移动,故A错误;
B 保持容器总体积不变,通入少量稀有气体,各组分的浓度不变,平衡不发生移动,故B错误;
C.该反应为放热反应,升高温度平衡向着向逆反应方向移动,故C正确;
故选C.
(3)根据图象可知,达到平衡时各组分的浓度为:c(A)=0.3mol/L,c(B)=0.1mol/L,c(C)=0.4mol/L,
T℃时,该反应化学平衡常数K=
=
≈533.3;该反应为放热反应,升高温度,平衡向着逆向移动,化学平衡常数减小,
故答案为:533.3;减小.
故答案为:A+3B?2C;放热;
(2)A.保持其他条件不变,增大压强,平衡向正反应方向移动,故A错误;
B 保持容器总体积不变,通入少量稀有气体,各组分的浓度不变,平衡不发生移动,故B错误;
C.该反应为放热反应,升高温度平衡向着向逆反应方向移动,故C正确;
故选C.
(3)根据图象可知,达到平衡时各组分的浓度为:c(A)=0.3mol/L,c(B)=0.1mol/L,c(C)=0.4mol/L,
T℃时,该反应化学平衡常数K=
| c2(C) |
| c3(B)?c(A) |
| (0.4)2 |
| (0.1)3×(0.3) |
故答案为:533.3;减小.
点评:本题考查化学平衡图象问题,题目难度较大,解答该题时注意分析图象的曲线变化特点,由图象得出反应的化学方程式为解答该题的关键.

练习册系列答案
相关题目
 T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.
T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示. C
C 环境问题备受世界关注.化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体己成为大气污染的主要因素.
环境问题备受世界关注.化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体己成为大气污染的主要因素. O2+Hb?CO
O2+Hb?CO N2(g)+2CO2(g)△H=-113kJ?mol-1
N2(g)+2CO2(g)△H=-113kJ?mol-1 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表: