题目内容
在一定条件下密闭容器中存在如下平衡CO2(g)+C(s)?2CO(g)(已知正反应为吸热反应),如果升高温度,气体混合物的平均相对分子质量将会( )
分析:该反应正反应是体积增大的吸热反应,升高温度平衡向正反应方向移动,混合气体的总质量增大,混合气体的总的物质的量增大,假定开始混合气体总质量为mg,总的物质的量为nmol,令升高温度达平衡时转化的C的物质的量为xmol,计算混合气体增大的质量、增大的物质的量,结合结合
=
判断.
. |
| M |
| m+△m |
| n+△n |
解答:解:该反应正反应是体积增大的吸热反应,升高温度平衡向正反应方向移动,混合气体的总质量增大,混合气体的总的物质的量增大,假定开始混合气体总质量为mg,总的物质的量为nmol,令升高温度达平衡时转化的C的物质的量为xmol,则混合气体增大的质量等于C的质量为12g/mol×xmol=12xg,
CO2(g)+C(s)?2CO(g)物质的量增大
1 2-1=1
xmol xmol
故升高温度达新平衡后,气体混合物的平均相对分子质量=
>
,故气体混合物的平均相对分子质量增大,
故选B.
CO2(g)+C(s)?2CO(g)物质的量增大
1 2-1=1
xmol xmol
故升高温度达新平衡后,气体混合物的平均相对分子质量=
| m+12x |
| n+x |
| m |
| n |
故选B.
点评:本题考查化学平衡移动与计算,难度中等,关键是理解平均相对分子质量的计算.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
对于在一定条件下密闭容器中进行的反应N2+3H2 2NH3,下列有关推断正确的是
2NH3,下列有关推断正确的是
| A.3mol H2与足量的N2在该容器内充分反应可生成2mol NH3 |
| B.当生成N2和NH3的速率之比为1:2时反应处于平衡状态 |
| C.在相同的温度和压强下,与不使用催化剂相比,使用催化剂可以提高平衡混合物中NH3的含量 |
| D.当反应速率之比v(N2): v(H2): v(NH3)=1:3:2时,反应处于平衡状态 |
 2NH3,下列有关推断正确的是( )
2NH3,下列有关推断正确的是( ) 4NO
(g)+ 6H2O(g)
4NO
(g)+ 6H2O(g)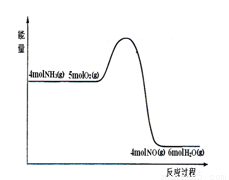
 2NH3,下列有关推断正确的是
2NH3,下列有关推断正确的是