题目内容
Ba2+ 是一种重金属离子,对生物体有害,环境监测小组欲利用Na2S2O3、KI、K2Cr2O7 等试剂测定某工厂废水中Ba2+的浓度.(1)现需配200mL 0.100mol/L 标准Na2S2O3溶液,所需要的玻璃仪器除200容量瓶、玻璃棒外,还需要______.
(2)需准确称取Na2S2O3的质量为______g.
(3)另取废水100.0mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀,沉淀经洗涤,过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-,再加入过量KI溶液反应,反应液中再滴加上述Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL,已知有关的离子方程式为:Cr2O72-+6I-+14H+→2Cr3++3I2+7H2O I2+2S2O32-→2I-+S4O62-.试计算该工厂废水中Ba2+的物质的量浓度.
【答案】分析:(1)根据配置溶液溶解、定容等操作来选择玻璃仪器;
(2)根据200mL 0.100mol/L 标准Na2S2O3溶液,利用n=cV来计算物质的量,再利用m=nM来计算其质量;
(3)由BaCrO4沉淀、CrO42-全部转化为Cr2O72-,Cr2O72-+6I-+14H+→2Cr3++3I2+7H2O I2+2S2O32-→2I-+S4O62-,得出废水中Ba2+与Na2S2O3的关系,代入即可计算.
解答:解:(1)因溶液固体需要在烧杯中,定容时需要用胶头滴管,故答案为:烧杯、胶头滴管;
(2)Na2S2O3的物质的量为0.2L×0.1mol/L=0.02mol,其质量为0.02mol×158g/mol=3.16g,故答案为:3.16;
(3)设该工厂废水中Ba2+的物质的量为x,
由BaCrO4沉淀、CrO42-全部转化为Cr2O72-,Cr2O72-+6I-+14H+→2Cr3++3I2+7H2O、I2+2S2O32-→2I-+S4O62-,
则2Ba2+~2BaCrO4~Cr2O72-~3I2~6S2O32-,
2 6
x 36.00mL×10-3L×0.100mol/L
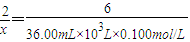 ,
,
解得x=12.00×10-4mol,
则c(Ba2+)= =0.012mol/L,
=0.012mol/L,
答:该工厂废水中Ba2+的物质的量浓度为0.012mol/L.
点评:本题考查溶液的配置、物质的量的计算及利用关系法来计算废水中离子的浓度,明确离子的关系是解答本题的关键,(3)是学生解答的难度和易错点.
(2)根据200mL 0.100mol/L 标准Na2S2O3溶液,利用n=cV来计算物质的量,再利用m=nM来计算其质量;
(3)由BaCrO4沉淀、CrO42-全部转化为Cr2O72-,Cr2O72-+6I-+14H+→2Cr3++3I2+7H2O I2+2S2O32-→2I-+S4O62-,得出废水中Ba2+与Na2S2O3的关系,代入即可计算.
解答:解:(1)因溶液固体需要在烧杯中,定容时需要用胶头滴管,故答案为:烧杯、胶头滴管;
(2)Na2S2O3的物质的量为0.2L×0.1mol/L=0.02mol,其质量为0.02mol×158g/mol=3.16g,故答案为:3.16;
(3)设该工厂废水中Ba2+的物质的量为x,
由BaCrO4沉淀、CrO42-全部转化为Cr2O72-,Cr2O72-+6I-+14H+→2Cr3++3I2+7H2O、I2+2S2O32-→2I-+S4O62-,
则2Ba2+~2BaCrO4~Cr2O72-~3I2~6S2O32-,
2 6
x 36.00mL×10-3L×0.100mol/L
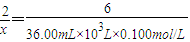 ,
,解得x=12.00×10-4mol,
则c(Ba2+)=
 =0.012mol/L,
=0.012mol/L,答:该工厂废水中Ba2+的物质的量浓度为0.012mol/L.
点评:本题考查溶液的配置、物质的量的计算及利用关系法来计算废水中离子的浓度,明确离子的关系是解答本题的关键,(3)是学生解答的难度和易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目