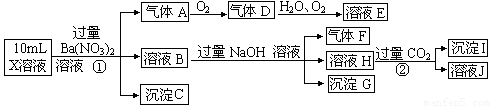
题目内容
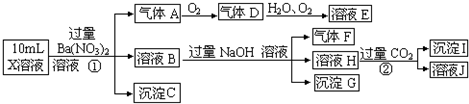
某强酸性溶液X中含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验内容如下:根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是 ,不能确定是否含有的离子(Q)是 ,若要确定该Q(若不止一种,可任选一种)不存在,其最可靠的化学方法是: .
(2)沉淀G的化学式为 .
(3)写出有关离子方程式:
①中生成A: .
②: .
(4)假设测定A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,且不能确定含有的离子(Q)只有一种.当沉淀C物质的量 ,表明Q离子一定是 .
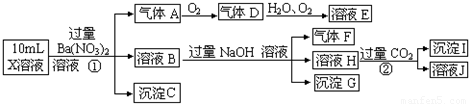
【答案】分析:在强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有
SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3,H为NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,以此解答(1)(2)(3)题,根据溶液电中性解答(4)题.
解答:解:(1)在强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3,H为NaOH和NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,检验方法是 取少量X溶液放在试管中,加入几滴KSCN,溶液不变红色说明无Fe3+; 或者取少量B溶液放在试管中,加入几滴AgNO3溶液,无白色沉淀说明无Cl-,
故答案为:Al3+、NH4+、Fe2+、SO42-;Fe3+、Cl-; 取少量X溶液放在试管中,加入几滴KSCN,溶液不变红色说明无
Fe3+; 或者取少量B溶液放在试管中,加入几滴AgNO3溶液,无白色沉淀说明无Cl-(其它合理答案也对).
(2)Fe2+离子被氧化为Fe3+离子,加入NaOH溶液后生成Fe(OH)3,故答案为:Fe(OH)3
(3)①Fe2+离子被氧化为Fe3+离子,反应的离子方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,
故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
②H为NaOH和NaAlO2混合物,通入过量二氧化碳后分别发生的反应为:
CO2+OH-=HCO3-,AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:CO2+OH-=HCO3-,AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
(4)A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,根据反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,可知离子为0.03mol,根据溶液电中性可知:2n(Fe2+)+3n(Al3+)+n(NH4+)=2n(SO42-),
n(SO42-)=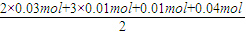 =0.07mol,当沉淀C物质的量>0.07mol时一定含有Fe3+离子,反之,含有Cl-离子,
=0.07mol,当沉淀C物质的量>0.07mol时一定含有Fe3+离子,反之,含有Cl-离子,
故答案为:>0.07mol,Fe3+(或者<0.07mol,Cl-)
点评:本题考查离子组推断题,题目具有一定难度,本题解答时一定要紧扣反应现象,推断各离子存在的可能性,本题易错点为(4)题,注意溶液电中性的利用.
SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3,H为NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,以此解答(1)(2)(3)题,根据溶液电中性解答(4)题.
解答:解:(1)在强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3,H为NaOH和NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,检验方法是 取少量X溶液放在试管中,加入几滴KSCN,溶液不变红色说明无Fe3+; 或者取少量B溶液放在试管中,加入几滴AgNO3溶液,无白色沉淀说明无Cl-,
故答案为:Al3+、NH4+、Fe2+、SO42-;Fe3+、Cl-; 取少量X溶液放在试管中,加入几滴KSCN,溶液不变红色说明无
Fe3+; 或者取少量B溶液放在试管中,加入几滴AgNO3溶液,无白色沉淀说明无Cl-(其它合理答案也对).
(2)Fe2+离子被氧化为Fe3+离子,加入NaOH溶液后生成Fe(OH)3,故答案为:Fe(OH)3
(3)①Fe2+离子被氧化为Fe3+离子,反应的离子方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,
故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
②H为NaOH和NaAlO2混合物,通入过量二氧化碳后分别发生的反应为:
CO2+OH-=HCO3-,AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:CO2+OH-=HCO3-,AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
(4)A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,根据反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,可知离子为0.03mol,根据溶液电中性可知:2n(Fe2+)+3n(Al3+)+n(NH4+)=2n(SO42-),
n(SO42-)=
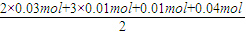 =0.07mol,当沉淀C物质的量>0.07mol时一定含有Fe3+离子,反之,含有Cl-离子,
=0.07mol,当沉淀C物质的量>0.07mol时一定含有Fe3+离子,反之,含有Cl-离子,故答案为:>0.07mol,Fe3+(或者<0.07mol,Cl-)
点评:本题考查离子组推断题,题目具有一定难度,本题解答时一定要紧扣反应现象,推断各离子存在的可能性,本题易错点为(4)题,注意溶液电中性的利用.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
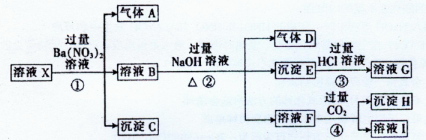
 —、Cl—、NO3—中的一种或几种,取该溶液进行连续实验,实验过程如下:
—、Cl—、NO3—中的一种或几种,取该溶液进行连续实验,实验过程如下: