题目内容
已知0.02 mol·L-1CH3COOH溶液和0.01 mol·L-1NaOH溶液以等体积混和后溶液呈酸性,则该混合液中微粒浓度关系正确的 ( )
| A.c (CH3COO-)>c (Na+) |
| B.c (Na+) + c (H+) =c (OH-) +c (CH3COOH)+c (CH3COO-) |
| C.c (CH3COOH)>c (CH3COO-) |
| D.c (CH3COOH)+c (CH3COO-)="0.02" mol·L-1 |
A
试题分析:已知0.02 mol·L-1CH3COOH溶液和0.01 mol·L-1NaOH溶液以等体积混和后溶液呈酸性,相当于是醋酸和醋酸钠等体积等浓度混合,显示酸性,说明醋酸的电离程度大于醋酸根的水解程度;所以c (CH3COO-)>c (Na+) ;c (CH3COOH)>c (CH3COO-) ;由电荷守恒:c (Na+) + c (H+) =c (OH-) +c (CH3COO-)所以c (Na+) + c (H+) <c (OH-) +c (CH3COOH)+c (CH3COO-) ;c (CH3COOH)+c (CH3COO-)="0.01" mol·L-1 ,故选A。
点评:醋酸的电离程度大于醋酸根的水解程度,所以醋酸和醋酸钠等体积等浓度混合后,显酸性,在计算时,可以这样考虑,如果正好显示中性,则,c (CH3COO-)=c (Na+) ,但是醋酸的电离程度大于醋酸根的水解程度,所以c (CH3COO-)>c (Na+)。

练习册系列答案
相关题目
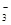 )>c(OH-)>c(H+)>c(CO
)>c(OH-)>c(H+)>c(CO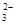 )
)  、Clˉ
、Clˉ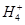 、Clˉ
、Clˉ