题目内容
为测定某镁铝合金样品中铝的含量,进行了下列实验:取一定量合金,加入100 mL 0.3 mol·L-1稀硫酸,合金完全溶解,产生的气体在标准状况下体积为560 mL;再加入0.2 mol·L-1 NaOH溶液至沉淀质量恰好不再变化,用去350 mL NaOH溶液。则所取样品中铝的物质的量为
| A.0.005 mol |
| B.0.010 mol |
| C.0.020 mol |
| D.0.030 mol |
B
本题考查镁铝合金与酸、碱反应的计算,意在考查考生对镁、铝性质的理解及化学计算能力。沉淀质量恰好不再变化,得到NaAlO2和Na2SO4溶液,根据S元素守恒,n(SO42- )=n(H2SO4)=0.1 L×0.3 mol·L-1=0.030 mol,根据Na元素守恒,则n(Na+)=n(NaOH)=0.2 mol·L-1×0.35 L=0.070 mol,则n(AlO2-)=0.070 mol-0.030 mol×2=0.010 mol,根据Al元素守恒,n(Al)=n(AlO2-)=0.010 mol,B项正确。

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目

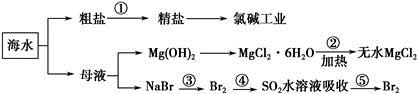
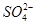 、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸