题目内容
MgSO4?7H2O在医药上常用做泻药,工业上可用氯碱工业中的一次盐泥为原料生产。已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分。其主要工艺如下:
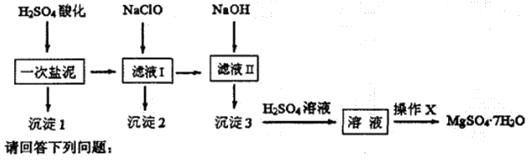
用H2SO4调节溶液PH至1~2,H2SO4作用是 。
(2)加NaClO溶液至PH=5~6并加热煮沸5~10分钟,沉淀2中主要含有MnO2和另外两种难溶物,这两种难溶物的化学式分别为 、 ;其中NaClO溶液将MnSO4转化为MnO2的离子方程式为 。
(3)检验滤液Ⅱ中是否含有Fe3+的实验方法是 。
(4)“操作X”是将溶液 、 、过滤洗涤,即得到MgSO4?7H2O晶体。
(5)准确称量制得的样品5g,用200mL水溶解,加入2 mol?L—1的盐酸5mL,在不断搅拌下滴加足量2 mol?L—1 BaCl2溶液,充分反应后,得沉淀4.46g,则样品纯度为 。

用H2SO4调节溶液PH至1~2,H2SO4作用是 。
(2)加NaClO溶液至PH=5~6并加热煮沸5~10分钟,沉淀2中主要含有MnO2和另外两种难溶物,这两种难溶物的化学式分别为 、 ;其中NaClO溶液将MnSO4转化为MnO2的离子方程式为 。
(3)检验滤液Ⅱ中是否含有Fe3+的实验方法是 。
(4)“操作X”是将溶液 、 、过滤洗涤,即得到MgSO4?7H2O晶体。
(5)准确称量制得的样品5g,用200mL水溶解,加入2 mol?L—1的盐酸5mL,在不断搅拌下滴加足量2 mol?L—1 BaCl2溶液,充分反应后,得沉淀4.46g,则样品纯度为 。
(1)溶解盐泥变成可溶性硫酸盐,除去Ca2+、SiO32-、CO32-
(2)Fe(OH)3、Al(OH)3 Mn2++ClO-+H2O=MnO2↓+Cl-+2H+
(3)取少量的上层滤液Ⅱ,加热KSCN,观察溶液是否显血红色,若显血红色则有Fe3+,若不显血红色则无Fe3+
(4)蒸发浓缩、冷却结晶
(5)93.5%
试题分析:
(1)H2SO4的作用主要是调节PH,溶解盐泥,除去CO32-,生成硅酸沉淀及CaSO4微溶除去Ca2+及SiO32-
(2)根据沉淀3只有Mg(OH)2所以沉淀2中有Fe(OH)3及Al(OH)3(原因是物质的Ksp不同,Fe3+及Al3+在PH较小时就可以沉淀);Mn2+被氧化成MnO2沉淀而ClO-被还原成Cl-,再根据溶液显酸性及电荷守恒配出方程式;
(3)检验离子操作过程应该为:取液、加试剂、观察现象、出结论
(5)根据原子守恒,MgSO4.7H2O——BaSO4,算出MgSO4.7H2O的质量[n(BaSO4)=0.019mol,取两位有效数字,由此得到答案为93.5%]

练习册系列答案
相关题目
 NH2COONH4(s) + Q (Q > 0 )
NH2COONH4(s) + Q (Q > 0 ) 

 形式存在
形式存在