题目内容
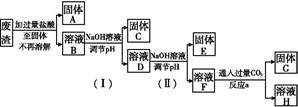
菱锌矿的主要成分是碳酸锌,还含有少量的Fe2O3、FeO、CuO等杂质。如图是以菱锌矿为原料制取轻质氧化锌的一种工艺流程,该流程还可以得到两种副产品——海绵铜和铁红。
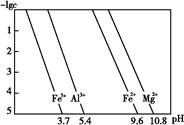
请结合下表数据,回答问题:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.3 | 9.7 |
| Fe3+ | 1.5 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
(1)下列试剂中,________(填代号)可作为试剂甲的首选。
A.KMnO4 B.Cl2 C.H2O2 D.浓硝酸
根据所选试剂写出与之反应的离子方程式:________________________________________________________________________________________________________________________________________________。
(2)氢氧化铁固体会吸附一些SO42-,如何洗涤Fe(OH)3固体以及如何判断是否洗涤干净?
洗涤方法:______________________________________________________________,判断是否洗涤干净的方法是_______________________________________。
(3)除铁步骤中加入氨水的目的是调节溶液的pH,其适宜的pH范围是______________;调节溶液pH时,除了氨水外,还可以加入下列物质中的________。
a.Zn b.ZnO c.Zn(OH)2 d.CuO
(4)经测定乙溶液中仍含有少量的Fe3+和Zn2+。若c(Fe3+)为4.0×10-17 mol·L-1,则c(Zn2+)为______________ mol·L-1。(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Zn(OH)2]=1.2×10-17)。
(1)C 2Fe2++H2O2+2H+=2Fe3++2H2O
(2)向过滤器中加入蒸馏水至浸没沉淀,待水自然流出,重复上述操作2~3次 用试管取少量洗涤液,滴加氯化钡溶液,若有白色沉淀则表明未洗净,反之则表明已洗净
(3)3.2≤pH<6.2 bc
(4)1.2×10-3
解析

TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
(1)实验室利用反应TiO2(s)+CCl4(g) TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:
TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下: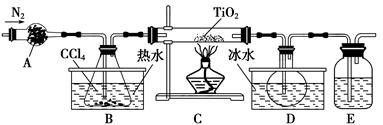
有关物质性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
仪器A的名称是________。装置E中的试剂是________。反应开始前依次进行如下操作:组装仪器、________、加装药品、通N2一段时间后点燃酒精灯。反应结束后的操作包括:①停止通N2 ②熄灭酒精灯 ③冷却至室温。正确的顺序为________(填序号)。欲分离D中的液态混合物,所采用操作的名称是________。
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶 FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+TiOSO4(aq)+2H2O(l)
水解 TiOSO4(aq)+2H2O(l)
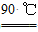 H2TiO3(s)+H2SO4(aq)
H2TiO3(s)+H2SO4(aq)简要工艺流程如下:
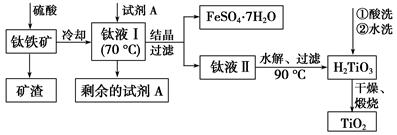
①试剂A为________。钛液Ⅰ需冷却至70 ℃左右,若温度过高会导致产品TiO2产率降低,原因是__________________________________________
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是________。这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是____________________(填化学式)。
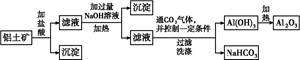
硝酸铝广泛用于有机合成、印染工业等。工业上以铝灰为原料(主要成分为Al,含少量Al2O3、Fe2O3、SiO2、CaO、MgO等)制备硝酸铝的工艺流程如下:
已知:Al(OH)3沉淀和溶解的pH如下表:
| Al(OH)3 | 开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀溶解完全 |
| pH | 3.3 | 5.0 | 7.8 | 12.8 |
回答下列问题:
(1)碱溶时,发生主反应的离子方程式为________________________________。
(2)工艺流程中第一次加入硝酸调pH=7.0的目的是__________________________________________________________。
pH=7.0时,溶液中c(Al3+)=________(通常条件下,Ksp[Al(OH)3]=1.3×10-33)。
(3)若忽略杂质跟酸、碱的反应,则在碱溶、调pH=7.0、酸溶过程中,理论上消耗碱、酸的物质的量之比n1(NaOH)∶n2(HNO3)∶n3(HNO3)=________。
(4)现用1 t铝灰制硝酸铝晶体[Al(NO3)3·9H2O],最后生产出7.5 t硝酸铝晶体,若生产过程中铝元素的损失率为10%,计算铝灰中铝元素的质量分数。
某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A受热分解的化学方程式为_________________________________。
(2)称取两种固体各2 g,分别加入两个小烧杯中,再各加10 mL 蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复至室温,向所得溶液中各滴入2滴酚酞溶液。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论___________________。
②同学们在两烧杯中还观察到以下现象。其中,盛放Na2CO3的烧杯中出现的现象是________________(填字母序号)。
A.溶液温度下降 B.溶液温度升高 C.滴入酚酞后呈浅红色 D.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中。
①两试管中均产生气体,________(填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈。
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是__________。
A.装置Ⅰ的气球体积较大 B.装置Ⅱ的气球体积较大
C.生成气体的体积根据盐酸计算 D.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5 mol·L-1的溶液,设计如下方案并对反应现象做出预测:
| 实验方案 | 预测现象 | 预测依据 |
| 操作1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应_________(写离子方程式)。 |
| 操作2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。 |
实施实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体。则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为_______________。
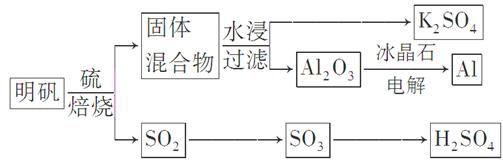 焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O
 2SO3(g) ΔH1=-197 kJ/mol;
2SO3(g) ΔH1=-197 kJ/mol;