题目内容
(1)下列有关仪器的使用,能实现的是 (填序号)A.用托盘天平称取11.70g食盐
B.用量筒量取12.36mL盐酸
C.用酸式滴定管量取21.20mL 0.10mol/L H2SO4溶液
D.用200mL容量瓶配制500mL0.1mol/L NaCl溶液
(2)现用物质的量浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
①酸式滴定管用蒸馏水洗净后,还应该进行的操作是 .
②如图是酸式滴定管中液面在滴定前后的读数:c (NaOH)= .
③若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会 .(填“偏大”、“偏小”或“无影响”)
(3)相同条件下pH=3的盐酸和pH=3的醋酸:
①取等体积两溶液,分别稀释至pH=4时,两者加水量的关系是:前者 后者;(填“>”、“<”或“=”,下同)
②取等体积的两溶液,分别加入等物质的量的相应钠盐固体少量,两溶液的pH大小关系是:前者 后者;
③各取两溶液VL,分别加入VLpH=11的NaOH,充分反应后,两溶液pH大小关系是:前者 后者.

【答案】分析:(1)A.托盘天平精确到0.1;
B.量筒精确到0.1;
C.滴定管精确到0.01;
D.容量瓶只能配置固定体积的溶液.
(2)①滴定管使用前应润洗;
②中和滴定中酸和碱的物质的量相等;
③根据关系式c(待测)×V(待测)=c(标准)×V(标准);
(3)①醋酸为弱酸,相同条件下pH=3的盐酸和pH=3的醋酸,醋酸浓度大,水中存在电离平衡:CH3COOH?CH3COO-+H+,加水稀释促进电离;
②从弱电解质的电离平衡移动的角度分析;
③相同条件下pH=3的盐酸和pH=3的醋酸,醋酸浓度大,加入相同的NaOH,反应后醋酸过量,溶液呈酸性.
解答:解:ⅠA.托盘天平精确到0.1,无法称出11.70g食盐,故A错误;
B.量筒精确到0.1,无法量取12.36ml盐酸,故B错误;
C.滴定管精确到0.01,可量取21.20ml 0.10mol/L H2SO4溶液,故C正确;
D.配制500ml 0.1mol/L NaCl溶液应用500ml容量瓶,故D错误;
故选C.
(2)①滴定管使用前应用待测液润洗,故答案为:用标准盐酸润;
②中和滴定中酸和碱的物质的量相等,(V2-V1)a=c (NaOH)V,故答案为: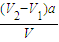 ;
;
③滴定前酸式滴定管尖嘴部分有气泡,滴定后尖嘴部分充满溶液,会导致体积读数偏大,测量结果偏大,故答案为:偏大;
(3)①因为醋酸为弱酸,相同条件下pH=3的盐酸和pH=3的醋酸,醋酸浓度大,水中存在:CH3COOH?CH3COO-+H+,加入水使c(H+)浓度减小,平衡右移,又有部分H+被电离出来,当稀释至c(H+)相同时,需要比强酸盐酸更多的水来稀释,故答案为:<;
②盐酸是强酸,相应的钠盐的水溶液呈中性,即PH=7,醋酸溶液中存在CH3COOH?CH3COO-+H+,加入CH3COONa,溶液CH3COO-浓度增大,抑制醋酸电离,溶液c(H+)减小,所以前者的PH小于后者,故答案为:<;
③相同条件下pH=3的盐酸和pH=3的醋酸,醋酸浓度大,取两溶液VL,分别加入VLpH=11的NaOH,充分反应后,盐酸呈中性,而醋酸过量,溶液呈酸性,则盐酸反应后溶液pH大,故答案为:>.
点评:本题考查酸碱混合的计算和判断以及电解质的比较,题目综合性较强,注意把握弱电解质的电离特点以及电离平衡移动的影响因素.
B.量筒精确到0.1;
C.滴定管精确到0.01;
D.容量瓶只能配置固定体积的溶液.
(2)①滴定管使用前应润洗;
②中和滴定中酸和碱的物质的量相等;
③根据关系式c(待测)×V(待测)=c(标准)×V(标准);
(3)①醋酸为弱酸,相同条件下pH=3的盐酸和pH=3的醋酸,醋酸浓度大,水中存在电离平衡:CH3COOH?CH3COO-+H+,加水稀释促进电离;
②从弱电解质的电离平衡移动的角度分析;
③相同条件下pH=3的盐酸和pH=3的醋酸,醋酸浓度大,加入相同的NaOH,反应后醋酸过量,溶液呈酸性.
解答:解:ⅠA.托盘天平精确到0.1,无法称出11.70g食盐,故A错误;
B.量筒精确到0.1,无法量取12.36ml盐酸,故B错误;
C.滴定管精确到0.01,可量取21.20ml 0.10mol/L H2SO4溶液,故C正确;
D.配制500ml 0.1mol/L NaCl溶液应用500ml容量瓶,故D错误;
故选C.
(2)①滴定管使用前应用待测液润洗,故答案为:用标准盐酸润;
②中和滴定中酸和碱的物质的量相等,(V2-V1)a=c (NaOH)V,故答案为:
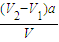 ;
;③滴定前酸式滴定管尖嘴部分有气泡,滴定后尖嘴部分充满溶液,会导致体积读数偏大,测量结果偏大,故答案为:偏大;
(3)①因为醋酸为弱酸,相同条件下pH=3的盐酸和pH=3的醋酸,醋酸浓度大,水中存在:CH3COOH?CH3COO-+H+,加入水使c(H+)浓度减小,平衡右移,又有部分H+被电离出来,当稀释至c(H+)相同时,需要比强酸盐酸更多的水来稀释,故答案为:<;
②盐酸是强酸,相应的钠盐的水溶液呈中性,即PH=7,醋酸溶液中存在CH3COOH?CH3COO-+H+,加入CH3COONa,溶液CH3COO-浓度增大,抑制醋酸电离,溶液c(H+)减小,所以前者的PH小于后者,故答案为:<;
③相同条件下pH=3的盐酸和pH=3的醋酸,醋酸浓度大,取两溶液VL,分别加入VLpH=11的NaOH,充分反应后,盐酸呈中性,而醋酸过量,溶液呈酸性,则盐酸反应后溶液pH大,故答案为:>.
点评:本题考查酸碱混合的计算和判断以及电解质的比较,题目综合性较强,注意把握弱电解质的电离特点以及电离平衡移动的影响因素.

练习册系列答案
相关题目
下列有关仪器的使用,能实现的是( )
| A、用托盘天平称取11.70g食盐 | B、用量筒量取12.36mL盐酸 | C、用酸式滴定管量取21.20mL 0.10mol/L H2SO4溶液 | D、用广泛pH试纸测定pH=9.1的溶液 |
 (1)下列有关仪器的使用,能实现的是
(1)下列有关仪器的使用,能实现的是 SO2是一种重要的化工原料,也是引起酸雨污染的重要来源.
SO2是一种重要的化工原料,也是引起酸雨污染的重要来源.
 (1)下列有关仪器的使用,能实现的是______(填序号)
(1)下列有关仪器的使用,能实现的是______(填序号)