题目内容
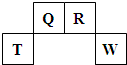
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与族序数相等,请回答下列问题:
(1)T的原子结构示意图为

(2)元素的原子的得电子能力为:Q
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是具有漂白性的气体,反应的化学方程式为:
(4)原子序数比R多1的元素的一种氢化物在二氧化锰催化作用下易分解为它的另一种氢化物,此分解反应的化学方程式是
(5)将12gQ单质在足量的氧气中燃烧,所得气体通入1L1.5mol?L-1NaOH溶液中,完全吸收后,溶液中大量存在的离子有
| Q | R | ||
| T | W |


(2)元素的原子的得电子能力为:Q
<
<
W(填“>”或“<”).(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是具有漂白性的气体,反应的化学方程式为:
S+2H2SO4(浓)
3SO2↑+2H2O
| ||
S+2H2SO4(浓)
3SO2↑+2H2O
| ||
(4)原子序数比R多1的元素的一种氢化物在二氧化锰催化作用下易分解为它的另一种氢化物,此分解反应的化学方程式是
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
| ||
(5)将12gQ单质在足量的氧气中燃烧,所得气体通入1L1.5mol?L-1NaOH溶液中,完全吸收后,溶液中大量存在的离子有
Na+、HCO3-、CO32-
Na+、HCO3-、CO32-
.分析:T所处的周期序数与族序数相等,应为第三周期第ⅢA族元素Al,根据元素所在周期表中的位置可知Q为C,R为N,W为S元素,根据原子的结构特点结合元素周期律的递变规律以及对应单质、化合物的性质解答该题.
解答:解:T所处的周期序数与族序数相等,应为第三周期第ⅢA族元素Al,根据元素所在周期表中的位置可知Q为C,R为N,W为S元素,则
(1)T为Al,为周期表13号元素,原子核外有3个电子层,最外层电子数为3,原子结构示意图为 ,
,
故答案为: ;
;
(2)根据S、C最高价氧化物对应的酸性硫酸强于碳酸,则可得非金属性S强于C,故答案为:<;
(3)S与浓H2SO4发生反应,从元素守恒看,肯定有水生成,另外为一气体,从化合价和性质看,只能是SO2,则反应的化学方程式为S+2H2SO4(浓)
3SO2↑+2H2O,
故答案为:S+2H2SO4(浓)
3SO2↑+2H2O;
(4)比R质子数多1的元素为O,存在H2O2转化为H2O的反应,反应的化学方程式为2H2O2
2H2O+O2↑,
故答案为:2H2O2
2H2O+O2↑;
(5)12g碳是1mol,燃烧生成1molCO2,与1.5molNaOH反应的化学方程式为:2CO2+3NaOH=NaHCO3+Na2CO3,生成碳酸钠、碳酸氢钠各0.5mol,溶液中大量存在的离子有Na+、HCO3-、CO32-,故答案为:Na+、HCO3-、CO32-.
(1)T为Al,为周期表13号元素,原子核外有3个电子层,最外层电子数为3,原子结构示意图为
 ,
,故答案为:
 ;
;(2)根据S、C最高价氧化物对应的酸性硫酸强于碳酸,则可得非金属性S强于C,故答案为:<;
(3)S与浓H2SO4发生反应,从元素守恒看,肯定有水生成,另外为一气体,从化合价和性质看,只能是SO2,则反应的化学方程式为S+2H2SO4(浓)
| ||
故答案为:S+2H2SO4(浓)
| ||
(4)比R质子数多1的元素为O,存在H2O2转化为H2O的反应,反应的化学方程式为2H2O2
| ||
故答案为:2H2O2
| ||
(5)12g碳是1mol,燃烧生成1molCO2,与1.5molNaOH反应的化学方程式为:2CO2+3NaOH=NaHCO3+Na2CO3,生成碳酸钠、碳酸氢钠各0.5mol,溶液中大量存在的离子有Na+、HCO3-、CO32-,故答案为:Na+、HCO3-、CO32-.
点评:本题考查元素推断以及对应化合物的性质,题目难度中等,本题推断角度为原子结构与元素周期表,侧重于元素化合物的考查.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 (2009?福建)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.
(2009?福建)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,
 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中元素T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中元素T所处的周期序数与主族序数相等,请回答下列问题:
 (2013?番禺区模拟)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列推断正确的是( )
(2013?番禺区模拟)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列推断正确的是( )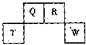 (2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: