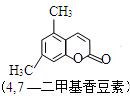
题目内容
2.在一定条件下,1mol N2和3mol H2混合后反应,达到平衡时测得混合气体的密度是同温同压下氢气的5倍,则氮气的转化率为( )| A. | 20% | B. | 30% | C. | 40% | D. | 50% |
分析 达到平衡时测得混合气体的密度是同温同压下氢气的5倍,则平衡时混合气体平衡摩尔质量为10g/mol,混合气体总质量等于起始的氮气与氢气质量之和,根据n=$\frac{m}{M}$计算平衡时混合气体总物质的量,再根据差量法计算参加反应的氮气物质的量,氮气的转化率=$\frac{反应的氮气物质的量}{氮气起始物质的量}$×100%.
解答 解:达到平衡时测得混合气体的密度是同温同压下氢气的5倍,则平衡时混合气体平衡摩尔质量为5×2g/mol=10g/mol,混合气体总质量=1mol×28g/mol+3mol×2g/mol=34g,则平衡时混合气体总物质的量为$\frac{34g}{10g/mol}$=3.4mol,
设参加反应的氮气物质的量为x,则:
N2+3 H2=2 NH3 物质的量减小
1mol 2mol
x 1mol+3mol-3.4mol=0.6mol
所以x=$\frac{1mol×0.6mol}{2mol}$=0.3mol
故氮的转化率为$\frac{0.3mol}{1mol}$×100%=30%
故选:B.
点评 本题考查化学平衡的计算,侧重考查学生的分析计算能力,难度不大.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
10.下列变化属于化学变化的是( )
| A. | 分镏 | B. | 裂解 | C. | 蒸馏 | D. | 萃取 |
17.下列关于苯( )的说法中正确的是( )
)的说法中正确的是( )
 )的说法中正确的是( )
)的说法中正确的是( )| A. | 分子组成符合通式CnH2n+2 | |
| B. | 分子中含有3个C-C键和3个C=C键 | |
| C. | 在空气中燃烧时产生较多的黑烟 | |
| D. | 苯中加入溴水后溴水层颜色变浅,这是发生了加成反应 |
11. 常温下MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是( )
常温下MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是( )
 常温下MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是( )
常温下MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是( )| A. | ROH是一种强碱,MOH是一种弱碱 | B. | 在x点,c(M+)=c(R+) | ||
| C. | 稀释前,c(ROH)<10c(MOH) | D. | 稀释前,c(ROH)=10c(MOH) |
 +CH3COCHCOOC2H5$→_{10℃搅拌12h}^{浓H_{2}SO_{4}}$
+CH3COCHCOOC2H5$→_{10℃搅拌12h}^{浓H_{2}SO_{4}}$