题目内容
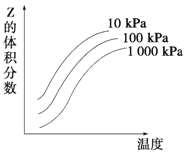
【题目】工业上用CO生产燃料甲醇。一定温度和容积条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。

请回答下列问题:
(1)在“图1”中,曲线____填“a”或“b”)表示使用了催化剂;没有使用催化剂时,在该温度和压强条件下反应CO(g)+2H2(g)![]() CH3OH(g)的△H= _________________________ 。
CH3OH(g)的△H= _________________________ 。
(2)下列说法正确的是 (_________)
A.起始充入的CO的物质的量为1mol
B.增加CO的浓度,H2的转化率会增大
C.容器中压强恒定时,反应达到平衡状态
(3)从反应开始到建立平衡,υ(CO)= _______;达到平衡时,c(H2)= ____ ,该温度下CO(g)+2H2(g) ![]() CH3OH(g)的化学平衡常数为______________。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡___________移动 (填“正向”、“逆向”或“不”)。
CH3OH(g)的化学平衡常数为______________。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡___________移动 (填“正向”、“逆向”或“不”)。
【答案】b -91kJ/mol ABC 0.075mol/(L·min) 0.5mo/L 12 正向
【解析】
本题主要考查化学反应中能量变化、化学反应过程中物质浓度变化图像以及化学平衡相关知识;(1)根据图中反应的活化能的大小来分析是否使用催化剂,利用反应前后的总能量来分析反应的能量变化;(2)A.由图2计算CO起始的量;B.增加CO浓度,会促使氢气的转化,但本身的转化率降低;C.该反应的正反应为气体分子数减小的反应,根据平衡时变量不变原则分析;(3)由图2计算用CO表示的反应速率,再利用反应中各物质的变化量之比等于化学计量数之比,来计算平衡时c(H2),化学平衡常数表达式为:![]() ,根据压缩体积,压强增大,平衡正向移动得出结论。
,根据压缩体积,压强增大,平衡正向移动得出结论。
(1)由图可知,反应的活化能b较小,所以b使用了催化剂,该反应中反应物的总能量大于生成物的总能量,故该反应为放热反应。由图可知,反应物为1molCO(g)和2molH2(g),生成物为1mol CH3OH(g),△H=419-510 kJ/mol =-91 kJ/mol。
(2)A.由图2可知CO的起始物质的量为1mol/L![]() 1L=1mol,故A项正确;B.增大CO浓度,会促使氢气的转化,氢气的转化率增大,故B项正确;C.该反应为反应前后压强不等的反应,当容器中压强不再变化时,该反应达到平衡状态,故C项正确。
1L=1mol,故A项正确;B.增大CO浓度,会促使氢气的转化,氢气的转化率增大,故B项正确;C.该反应为反应前后压强不等的反应,当容器中压强不再变化时,该反应达到平衡状态,故C项正确。
(3)由图2可知,反应中减小的CO的浓度为1mol/L-0.25mol/L=0.75mol/L,10min时达到平衡,则用CO表示的化学反应速率为![]() =0.075mol/(L·min),因反应中各物质的变化量之比等于化学计量数之比,则c(H2)=2mol/L-0.75mol/L
=0.075mol/(L·min),因反应中各物质的变化量之比等于化学计量数之比,则c(H2)=2mol/L-0.75mol/L![]() 2=0.5mol/L,该化学反应平衡常数为
2=0.5mol/L,该化学反应平衡常数为![]() =
=![]() =12,该反应正向为体积缩小的反应,压缩体积,压强将增大,故平衡将正向移动。
=12,该反应正向为体积缩小的反应,压缩体积,压强将增大,故平衡将正向移动。

 名校课堂系列答案
名校课堂系列答案【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I表示)如表所示:
I1 | I2 | I3 | I4 | I5 | |
电离能(kJ/mol) | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是___________价,其基态原子电子排布式为___________。
(2)往硫酸铜溶液中加入过量氨水,可形成[Cu(NH3)4]SO4,溶液,该溶液可用于溶解纤维素。
①[Cu(NH3)4]SO4中阴离子的立体构型是___________。
②除硫元素外,[Cu(NH3)4]SO4中所含元素的电负性由小到大的顺序为___________。
③NF3与NH3的空间构型相同,中心原子的轨道杂化类型均为___________。但NF3不易与Cu2+形成化学键,其原因是___________。
(3)一种Hg-Ba-Cu-O高温超导材料的晶胞(长方体)如图所示。
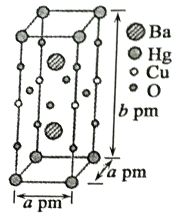
①该物质的化学式为___________。
②已知该晶胞中两个Ba2+的间距为cpm。则距离Ba2+最近的Hg+数目为___________个,二者的最短距离为___________pm。(列出计算式即可,下同)
③设该物质的摩尔质量为M,阿伏加德罗常数的值为NA,则该晶体的密度为___________g·cm-3。