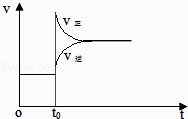题目内容
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g) ![]() 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示.下列说法中正确是( )
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示.下列说法中正确是( ) 
A.30min时降低温度,40min时升高温度
B.8min前A的平均反应速率为0.08mol/(Ls)
C.反应方程式中的x=1,正反应为吸热反应
D.20min~40min间该反应的平衡常数均为4
【答案】D
【解析】解:A.由图像可知,30min时只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,则正反应为放热反应,故A错误;B.反应从开始到8min内A浓度减少了0.64mol/L,故A的反应速率为0.08 mol/(Lmin),故B错误;
C.由开始到达到平衡,A、B的浓度减少的量相同,由此可知X=1,则增大压强平衡不移动,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,则正反应为放热反应,故C错误;
D.20min~40min间正逆反应速率相等,各物质的物质的量都不变,反应处于平衡状态,30min~40min,速率降低,为降低压强,平衡常数不变,20min~40min平衡常数相同,由图可知20min时c(A)=c(B)=1mol/L,c(C)=2mol/L,所以平衡常数k= ![]() =4,故D正确.
=4,故D正确.
故选:D.
【考点精析】认真审题,首先需要了解反应速率的定量表示方法(反应速率的单位:mol/(L·min)或mol/(L·s) v=△c-△t),还要掌握化学平衡常数的含义(指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度不变的状态)的相关知识才是答题的关键.

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案