题目内容
某研究性学习小组成员,利用稀硫酸与某金属的反应来探究影响化学反应速率的因素,下表是研究过程中记录的实验数据(表中某些数据记录已模糊不清,个别数据已丢失).
若实验操作、数据记录均是正确的,试分析上述数据回答下列问题:
(1)该实验主要是探究
(2)经仔细辨认,模糊的数据疑为25、50、125、250,试将这些疑似数据填入表中,使实验数据较为合理.
(3)试猜测实验9反应前溶液的温度约为
| 实验 序号 |
金属 质量(g) |
金属 状态 |
c(H2SO4)(mol/L) | V(H2SO4) (mL) |
溶液温度(℃) | 金属消失的 时间(s) | |
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 数据模糊 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 数据模糊 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 数据模糊 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 数据模糊 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 数据丢失 | 44 | 40 |
(1)该实验主要是探究
金属表面积、硫酸溶液浓度、反应温度
金属表面积、硫酸溶液浓度、反应温度
对反应速率的影响.(2)经仔细辨认,模糊的数据疑为25、50、125、250,试将这些疑似数据填入表中,使实验数据较为合理.
(3)试猜测实验9反应前溶液的温度约为
30
30
℃.推测的依据是等量的金属和酸反应放出的热量基本相同,使等量的溶液温度升高约15℃
等量的金属和酸反应放出的热量基本相同,使等量的溶液温度升高约15℃
.分析:(1)根据实验的条件找出相同的、不同的物理量,出现不同的物理量则是要探究的条件.金属的质量相同但状态不同,则探究其接触面积与反应速率的关系;硫酸的体积相同但浓度不同,所以考查了其浓度对反应速率的影响;溶液温度不同,所以探究温度对反应速率的影响;
(2)对比实验的异同,比较反应速率,结合外界条件对反应速率的影响可得出模糊的数据;
(3)等量的金属参加反应时,放出的热量相同,则溶液温度升高的数值应和其它实验相同,以此判断.
(2)对比实验的异同,比较反应速率,结合外界条件对反应速率的影响可得出模糊的数据;
(3)等量的金属参加反应时,放出的热量相同,则溶液温度升高的数值应和其它实验相同,以此判断.
解答:解:(1)根据实验的条件找出相同的、不同的物理量,出现不同的物理量则是要探究的条件.金属的质量相同但状态不同,则探究其接触面积与反应速率的关系;硫酸的体积相同但浓度不同,所以考查了其浓度对反应速率的影响;溶液温度不同,所以探究温度对反应速率的影响.将三者影响因素综合考虑,可得出如下结论,金属表面积越大,反应速率越快;硫酸浓度越大,反应速率越快;温度越高,反应速率越快,
故答案为:金属表面积、硫酸溶液浓度、反应温度;
(2)实验1和3相比较,3浓度较大,反应速率较大,所用时间应小于500s,实验3和4相比较,实验3浓度较小,则所用时间应大于200s,则实验3模糊数据应为250,实验5与实验2相比较,金属表面积相等,但实验5浓度较大,反应速率应较大,则实验5时间应小于50,应为25s,实验6与实验4相比较,实验6浓度较大,反应速率较大,所用时间应小于200s,与实验8相比较,浓度较小,所用时间应大于100s,则实验6模糊数据应为125,等量的金属参加反应时,放出的热量相同,则溶液温度升高的数值应和其它实验相同,则实验7的模糊数据应为50,
故答案为: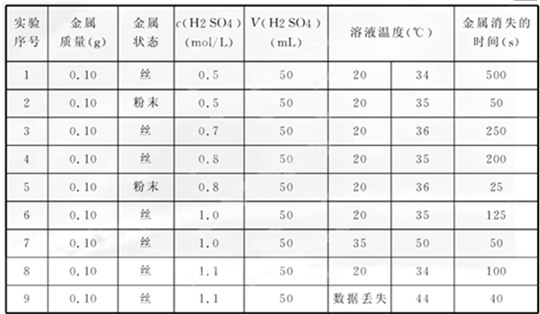 ;
;
(3)等量的金属和酸反应放出的热量基本相同,有表中数据可知使等量的溶液温度升高约15℃,则实验9反应前溶液的温度约为30℃,
故答案为:30;等量的金属和酸反应放出的热量基本相同,使等量的溶液温度升高约15℃.
故答案为:金属表面积、硫酸溶液浓度、反应温度;
(2)实验1和3相比较,3浓度较大,反应速率较大,所用时间应小于500s,实验3和4相比较,实验3浓度较小,则所用时间应大于200s,则实验3模糊数据应为250,实验5与实验2相比较,金属表面积相等,但实验5浓度较大,反应速率应较大,则实验5时间应小于50,应为25s,实验6与实验4相比较,实验6浓度较大,反应速率较大,所用时间应小于200s,与实验8相比较,浓度较小,所用时间应大于100s,则实验6模糊数据应为125,等量的金属参加反应时,放出的热量相同,则溶液温度升高的数值应和其它实验相同,则实验7的模糊数据应为50,
故答案为:
 ;
;(3)等量的金属和酸反应放出的热量基本相同,有表中数据可知使等量的溶液温度升高约15℃,则实验9反应前溶液的温度约为30℃,
故答案为:30;等量的金属和酸反应放出的热量基本相同,使等量的溶液温度升高约15℃.
点评:本题考查化学反应速率的实验探究,题目难度中等,本题注意分析表中数据的异同,结合浓度、温度以及固体表面积的大小进行比较,得出结论.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目