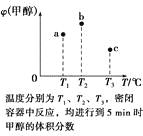
题目内容
【题目】微量元素硼和镁对植物的叶的生长和人体骨骼的健康有着十分重要的作用。
(1)写出基态B原子的轨道表达式___________________。
(2)三价B易形成配离子,如[B(OH)4]-、[BH4]-等。[B(OH)4]-的结构式为___________________ (标出配位键),其中心原子的杂化方式为式________,写出[BH4]-的两种等电子体________________。
(3)图1表示多硼酸根的一种无限长的链式结构,其化学式可表示为____________(以n表示硼原子的个数)。

(4)硼酸晶体是片层结构,图2表示的是其中一层的结构。层间存在的作用力有_________________;硼酸晶体在冷水中溶解度很小,但在热水中较大,原因是_____________________。
(5)三氯化硼的熔点比氯化镁的熔点低,原因是_________________________________________。
(6)镁属六方最密堆积(图3),其晶胞结构如图4所示,若镁原子半径为apm,则镁晶体的密度为_________________________________g/cm3(用含a的代数式表示)。

【答案】 ![]()
 sp3 CH4 、NH4+ (BO2)nn- 氢键、范德华力 晶体中硼酸分子间以氢键缔合在一起,难以溶解;加热时,晶体中部分氢键被破坏,溶解度增大 三氯化硼为分子晶体,而氯化镁为离子晶体,范德华力比离子键弱
sp3 CH4 、NH4+ (BO2)nn- 氢键、范德华力 晶体中硼酸分子间以氢键缔合在一起,难以溶解;加热时,晶体中部分氢键被破坏,溶解度增大 三氯化硼为分子晶体,而氯化镁为离子晶体,范德华力比离子键弱 ![]()
【解析】(1)B的原子序数是5,基态B原子核外电子排布式为1s2s22p1,所以轨道表达式为![]() 。(2)三价B易形成配离子,因此在[B(OH)4]-中氧原子提供孤对电子,则[B(OH)4]-的结构式为
。(2)三价B易形成配离子,因此在[B(OH)4]-中氧原子提供孤对电子,则[B(OH)4]-的结构式为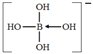 。B的价层电子对数是4,则其中心原子的杂化方式为式为sp3。原子数和价电子数分别都相等的是等电子体,则[BH4]-的两种等电子体分别是 CH4、NH4+。(3)从图可看出,每个单元都有一个B,有一个O完全属于这个单元,剩余的2个O分别为2个单元共用,所以B:O=1:(1+2×1/2)=1:2,化学式为(BO2)nn-;(4)氧原子能与氢元素形成氢键,因此层间存在的作用力有氢键、范德华力;由于晶体中硼酸分子间以氢键缔合在一起,难以溶解;加热时,晶体中部分氢键被破坏,导致溶解度增大。(5)三氯化硼为分子晶体,而氯化镁为离子晶体,范德华力比离子键弱,所以氯化镁的熔点高于三氯化硼。(6)镁属六方最密堆积,若镁原子半径为apm,底面积是(2a×10-10)2cm2,体对角线是4a×10-10cm,面对角线是
。B的价层电子对数是4,则其中心原子的杂化方式为式为sp3。原子数和价电子数分别都相等的是等电子体,则[BH4]-的两种等电子体分别是 CH4、NH4+。(3)从图可看出,每个单元都有一个B,有一个O完全属于这个单元,剩余的2个O分别为2个单元共用,所以B:O=1:(1+2×1/2)=1:2,化学式为(BO2)nn-;(4)氧原子能与氢元素形成氢键,因此层间存在的作用力有氢键、范德华力;由于晶体中硼酸分子间以氢键缔合在一起,难以溶解;加热时,晶体中部分氢键被破坏,导致溶解度增大。(5)三氯化硼为分子晶体,而氯化镁为离子晶体,范德华力比离子键弱,所以氯化镁的熔点高于三氯化硼。(6)镁属六方最密堆积,若镁原子半径为apm,底面积是(2a×10-10)2cm2,体对角线是4a×10-10cm,面对角线是![]() ,所以高是
,所以高是![]() ,晶胞体积是
,晶胞体积是![]() ,则镁晶体的密度为
,则镁晶体的密度为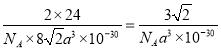 g/cm3。
g/cm3。