题目内容
【题目】铁是人类较早使用的金属之一,运用铁及其化合物的知识,完成下列问题.
(1)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜片制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式: . 某问学对FeCl3腐蚀铜后所得溶液的组成进行测定:取少最待侧溶液,滴入KSCN 溶液后显红色.由此可知,该溶液中所含金属阳离子有 .
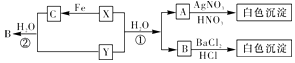
(2)欲从废液中回收铜,并重新获得FeCl3溶液.某同学设计如下实验方案: 
①写出上述实验中有关物质的化学式:A;B .
②写出通入气体C的化学方程式: .
【答案】
(1)2Fe3++Cu=2Fe2++Cu2+; Fe3+、Fe2+、Cu2+
(2)Fe; HCl;2FeCl2+Cl2=2FeCl3
【解析】解:(1)FeCl3溶液与铜反应生成氯化铜、氯化亚铁,离子反应为2Fe3++Cu=2Fe2++Cu2+;取少量待测溶液,滴入KSCN溶液呈红色,则一定含铁离子,则Cu不足,溶液中还含Fe2+、Cu2+;
所以答案是:2Fe3++Cu=2Fe2++Cu2+;Fe3+、Fe2+、Cu2+;(2)腐蚀废液中含有氯化铜、氯化亚铁,加入过量的铁可以和氯化铜反应生成金属铜和氯化亚铁,故A为Fe,经过滤所得滤液是氯化亚铁,滤渣是金属铜和过量的铁,铜不能盐酸反应,而金属铁可以,加入过量B为盐酸可以将铜分离,得到的滤液为氯化亚铁,滤液合并后通入氯气,能将亚铁离子氧化为三价铁,
①由上述分析可知,A为Fe,B为HCl;
所以答案是:Fe;HCl;
②C为氯气,通入C和氯化亚铁反应生成氯化铁,方程式为2FeCl2+Cl2=2FeCl3;
所以答案是:2FeCl2+Cl2=2FeCl3.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目