题目内容
实验室用碳酸钠粉末配制500mL 0.50mol/L Na2CO3溶液.(1)配制上述溶液,需要Na2CO3的质量______.
(2)配制上述溶液除需要玻璃棒、胶头滴管外,还需要的仪器有______、______、______.
(3)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”、“偏低”、“不变”)
①没有洗涤烧杯内壁和玻璃棒.______.
②定容时俯视容量瓶的刻度线.______.
③如果加水超过了刻度线,取出水使液面恰好到刻度线.______.
(4)如果称量时药品和砝码位置颠倒了(10g以下用游码),其他操作均正确.则所得溶液的物质的量浓度为______.
(5)如果碳酸钠粉末中混入了碳酸氢钠,则配制出的溶液跟V L、c mol/L盐酸反应时消耗的体积(填“大于”、“小于”、“等于”)______VL.
【答案】分析:(1)将数据代人m=n?M=c?v?M进行计算;
(2)根据配制一定物质的量浓度的溶液的实验操作步骤来确定溶液配制所需仪器;
(3)①会导致溶质的物质的量减少;
②该操作导致定容时溶液的体积减少;
③会导致配制的溶液的体积偏大;
(4)根据天平平衡原理有左盘质量=右盘质量+游码数据,据此计算溶质的物质的量及浓度;
(5)1mol杂质碳酸氢钠消耗1mol氯化氢,即84g碳酸钠消耗1mol氯化氢;而1mol碳酸钠质量是84g,消耗盐酸2mol,显然碳酸氢钠消耗的盐酸少,据此进行判断.
解答:解:(1)实验室配制500mL0.50mol/LNa2CO3溶液,需要Na2CO3的质量为:0.5L×0.50mol/L×106g/mol=26.5g,
故答案为:26.5g;
(2)溶液配制操作步骤有:称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取药品,在烧杯中溶解,并用玻璃棒搅拌,冷却后转移到500ml容量瓶中,并用玻璃棒引流,洗涤并将该洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以还需要托盘天平、500 mL容量瓶、烧杯,
故答案为:托盘天平、500 mL容量瓶、烧杯;
(3)①没有洗涤烧杯内壁和玻璃棒,会导致所配制的溶液中溶质的物质的量减小,浓度偏低,
故答案为:偏低;
②定容时俯视容量瓶的刻度线,配制的溶液的体积偏小,配制的溶液的浓度偏高,
故答案为:偏高;
③如果加水超过了刻度线,取出水使液面恰好到刻度线,导致配制的溶液的体积偏大,浓度偏低,
故答案为:偏低;
(4)称量样品时,药品放在天平右盘上,砝码放在天平左盘上,则实际称量的碳酸钠晶体是20g-6.5g=13.5g,碳酸钠的物质的量是: mol≈0.127mol,溶液中溶质的物质的量为:
mol≈0.127mol,溶液中溶质的物质的量为: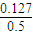 mol/L≈0.25mol/L,
mol/L≈0.25mol/L,
故答案为:0.25 mol/L;
(5)由于1mol杂质碳酸氢钠消耗1mol氯化氢,即84g碳酸钠消耗1mol氯化氢;而1mol碳酸钠质量是84g,消耗盐酸2mol,显然碳酸氢钠消耗的盐酸少,
含有杂质的溶液等体积消耗的盐酸体积少,所以配制出的溶液跟V L、c mol/L盐酸反应时消耗的体积要大于VmL,
故答案为:大于.
点评:本题考查一定物质的量浓度溶液的配制操作及误差分析等,难度中等,注意根据c= 理解溶液的原理与误差分析.
理解溶液的原理与误差分析.
(2)根据配制一定物质的量浓度的溶液的实验操作步骤来确定溶液配制所需仪器;
(3)①会导致溶质的物质的量减少;
②该操作导致定容时溶液的体积减少;
③会导致配制的溶液的体积偏大;
(4)根据天平平衡原理有左盘质量=右盘质量+游码数据,据此计算溶质的物质的量及浓度;
(5)1mol杂质碳酸氢钠消耗1mol氯化氢,即84g碳酸钠消耗1mol氯化氢;而1mol碳酸钠质量是84g,消耗盐酸2mol,显然碳酸氢钠消耗的盐酸少,据此进行判断.
解答:解:(1)实验室配制500mL0.50mol/LNa2CO3溶液,需要Na2CO3的质量为:0.5L×0.50mol/L×106g/mol=26.5g,
故答案为:26.5g;
(2)溶液配制操作步骤有:称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取药品,在烧杯中溶解,并用玻璃棒搅拌,冷却后转移到500ml容量瓶中,并用玻璃棒引流,洗涤并将该洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以还需要托盘天平、500 mL容量瓶、烧杯,
故答案为:托盘天平、500 mL容量瓶、烧杯;
(3)①没有洗涤烧杯内壁和玻璃棒,会导致所配制的溶液中溶质的物质的量减小,浓度偏低,
故答案为:偏低;
②定容时俯视容量瓶的刻度线,配制的溶液的体积偏小,配制的溶液的浓度偏高,
故答案为:偏高;
③如果加水超过了刻度线,取出水使液面恰好到刻度线,导致配制的溶液的体积偏大,浓度偏低,
故答案为:偏低;
(4)称量样品时,药品放在天平右盘上,砝码放在天平左盘上,则实际称量的碳酸钠晶体是20g-6.5g=13.5g,碳酸钠的物质的量是:
 mol≈0.127mol,溶液中溶质的物质的量为:
mol≈0.127mol,溶液中溶质的物质的量为: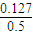 mol/L≈0.25mol/L,
mol/L≈0.25mol/L,故答案为:0.25 mol/L;
(5)由于1mol杂质碳酸氢钠消耗1mol氯化氢,即84g碳酸钠消耗1mol氯化氢;而1mol碳酸钠质量是84g,消耗盐酸2mol,显然碳酸氢钠消耗的盐酸少,
含有杂质的溶液等体积消耗的盐酸体积少,所以配制出的溶液跟V L、c mol/L盐酸反应时消耗的体积要大于VmL,
故答案为:大于.
点评:本题考查一定物质的量浓度溶液的配制操作及误差分析等,难度中等,注意根据c=
 理解溶液的原理与误差分析.
理解溶液的原理与误差分析. 
练习册系列答案
相关题目