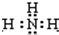题目内容
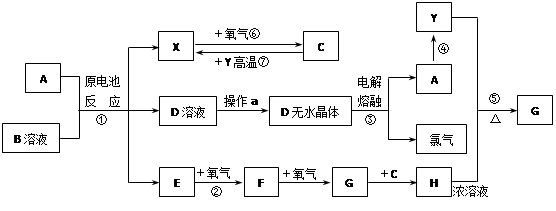
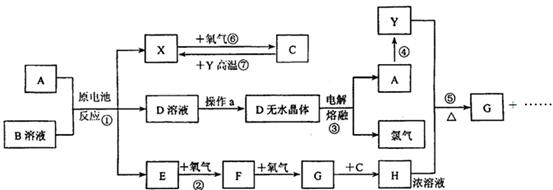
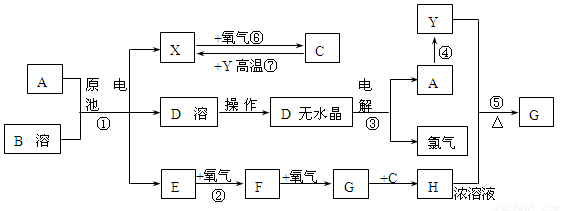
已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质),H溶液具有强氧化性、强酸性。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:
(注意:其中有些反应的条件及部分生成物被略去)
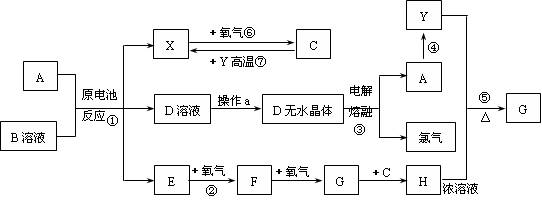
请填写下列空白:
(1)反应④为A在二氧化碳中燃烧,生成黑色固体单质Y和A的氧化物,其反应方程式为
。
(2)从D溶液制备D的无水晶体的“操作a”为 。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程式为 。
(5)原电池反应①中正极的电极反应式为 。
(6)A在元素周期表中有位置是:第_________周期、第__________族。
(7)Y的同素异形体有__________、___________、____________等。
(1)2Mg+CO2===2MgO+C;
(2)将D溶液在HCl气流中蒸干;
(3)②4NH3+5O2![]() 4NO+6H2O; (2分)
4NO+6H2O; (2分)
(4)⑤C+4HNO3(浓)![]() CO2+4NO2↑+2H2O
CO2+4NO2↑+2H2O
(5)2NH4++2e- = 2NH3↑+H2↑
(6)三 ⅡA
(7)金刚石 石墨 碳六十
解析:
本题为无机框图题。从题中的信息可知,B是氯化铵,A与石墨作电极,B的浓溶液作电解质,构成原电池,反应④为A在二氧化碳中燃烧,则A是金属镁,负极反应是Mg-2e-=Mg2+,正极反应为:2NH4++2e-=2NH3+H2,因为C常温下是液体,则X是氢气,D是氯化铵,E是氨气,反应⑥是氢气在氧气中燃烧生成水,反应②是氨气的催化氧化:4NH3+5O2![]() 4NO+6H2O,F是NO,继续和氧气反应生成NO2,G是NO2,NO2与水反应生成H,H是硝酸。反应③是MgCl2
4NO+6H2O,F是NO,继续和氧气反应生成NO2,G是NO2,NO2与水反应生成H,H是硝酸。反应③是MgCl2![]() Mg+Cl2↑,反应④为A在二氧化碳中燃烧生成Y,2Mg+CO2===2MgO+C,Y能够与浓硝酸反应,则Y是碳,与硝酸反应生成的气体G是CO2,方程式为C+4HNO3(浓)
Mg+Cl2↑,反应④为A在二氧化碳中燃烧生成Y,2Mg+CO2===2MgO+C,Y能够与浓硝酸反应,则Y是碳,与硝酸反应生成的气体G是CO2,方程式为C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O。
CO2↑+4NO2↑+2H2O。