题目内容
【题目】【化学-选修3:物质结构与性质】磷是人体含量较多的元素之一,磷的化合物在药物生产和农药制造等方面用途非常广泛。回答下列问题:
(1)基态磷原子核外共有________个未成对的电子。
(2)P4S3可用于制造火柴,其结构如图所示。
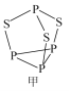
①电负性:磷_______硫;第一电离能:磷_______硫; (填“>”或“<)。
②P4S3中硫原子的杂化轨道类型为_______。
(3)N、P、As、Sb均是第VA族的元素。
①上述元素的氢化物的沸点关系如图乙所示,沸点:PH33,原因是_______;沸点:PH333,原因是_______。
②某种磁性氮化铁的晶胞结构如图丙所示,该化合物的化学式为_______。
(4)磷化铝熔点为2000℃,它与晶体硅互为等电子体,磷化铝晶胞结构如图丁所示。
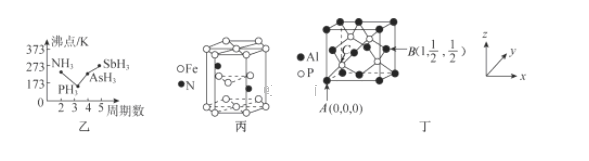
①图中A点和B点的原子坐标参数如图丁所示,则C点的原子坐标参数为_______。
②磷化铝晶体的密度为ρg·cm-3用NA表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个铝原子之间的距离为_______cm。
【答案】 3 < > sp3 NH3分子间存在分子间氢键 相对分子质量不断增大,分子间作用力不断增强 Fe3N (![]() 、
、![]() 、
、![]() )
) ![]()
【解析】(1) 基态磷原子核外电子排布式为1s22s22p63s23p3,所以在3p上有3个未成对的电子;
(2)①根据元素周期表中电负性的变化规律,同周期从左到右,电负性逐渐增大,所以磷元素的电负性小于硫元素的;已知基态硫原子核外电子排布式为1s22s22p63s23p4,基态磷原子核外电子排布式为1s22s22p63s23p3,根据同周期第一电离能从左到右逐渐增大的规律,磷元素的第一电离能应小于硫元素的,但在磷原子的3p能级上是比较稳定的半满状态,所以磷元素的第一电离能大于硫元素的;②由P4S3的结构可知,硫原子形成两个呈一定角度的共价键,还有两个孤对电子,所以其杂化类型为sp3;
(3)①由于N元素的原子半径小,最外层电子数多,具有很强的吸引电子能力,可以吸引另一个NH3分子中氢原子而形成氢键,使分子间作用力增强,导致沸点高于PH3;而PH3、AsH3和SbH3是组成、结构相似的物质,分子间作用力随相对分子质量的增大而增强,导致沸点依次升高;②在磁性氮化铁的晶胞结构中,根据原子分摊原则可得:Fe=![]() N=2,所以其化学式为Fe3N;
N=2,所以其化学式为Fe3N;
(4)①根据图丁中A点和B点坐标参数可知,该晶胞的棱长为1,而C点在该晶胞的![]() 立方体的中心,所以其坐标参数为(
立方体的中心,所以其坐标参数为(![]() ,
,![]() ,
,![]() );②在该晶胞中,最近的两个铝原子间的距离是面对角线的一半,其中Al=
);②在该晶胞中,最近的两个铝原子间的距离是面对角线的一半,其中Al= ![]() =4,P=4,所以其化学式为Al4P4,摩尔质量为232g/mol,该其质量为m=
=4,P=4,所以其化学式为Al4P4,摩尔质量为232g/mol,该其质量为m=![]() g,则其棱长=
g,则其棱长=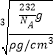 =
=![]() cm,所以最近的两个铝原子之间的距离为
cm,所以最近的两个铝原子之间的距离为![]() cm。
cm。

 科学实验活动册系列答案
科学实验活动册系列答案