题目内容
将铁和三氧化二铁的混合物2.72g加入50 mL 1.6 mol/L的盐酸中,恰好完全溶解.经用KSCN溶液检验,溶液不显红色.若忽略化学反应中溶液体积的变化,则在所得溶液中的Fe2+的物质的量浓度为
- A.0.3 mol/L
- B.0.4 mol/L
- C.0.8 mol/L
- D.1.6 mol/L

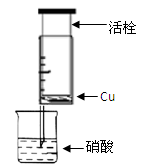
(13分)某研究性学习小组设计不同实验方案来研究硝酸的性质。
(1)甲组同学设计下图装置来证实稀硝酸与铜反应,步骤如下。
A、检验50ml针筒的气密性。
B、抽出活栓,往针筒内放入一小块铜片,把针筒活栓推到底,将针筒下端玻璃管浸入蒸馏水中,抽拉活栓,吸入约10mL蒸馏水,发现针筒内仍有空气,然后 。
C、将针筒下端玻璃管浸入浓硝酸中,抽拉活栓,缓缓吸入4mL浓硝酸,将针筒下端套上橡皮管,然后用铁夹夹住。
回答以下相关问题:
①B中应补充的操作是 。
②一段时间后在针筒内观察到溶液颜色为蓝色,有 色气体产生。该反应的离子方程式为 。
③反应停止后,针筒内产生了气体,要验证产生的气体是NO,还需进一步进行的操作是 。
(2)乙组同学也用此装置直接抽取浓硝酸和铜反应,发现溶液是绿色的,为了探究绿色的原因,乙组同学又做了三组对比实验,具体如下:
| 组 | m(Cu)/g | 硝酸(过量) | 溶液颜色 |
| A | 1 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| B | 0.5 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| C | 2 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 |
根据乙组同学三组对比实验回答问题:
①一种观点认为:这可能是Cu2+浓度差异的结果,你同意这种看法吗?(填“同意”或“不同意”)__________,原因是 。(结合表格信息加以阐述)
②另一种观点认为:溶液呈绿色是铜与浓硝酸反应时产生的NO2溶于过量浓硝酸显黄色,加上和蓝色的硝酸铜溶液混在一起,使溶液呈绿色。为了验证推断是否正确, 三位同学分别设计了三种方案,并进行验证:
方案一:将绿色溶液转移至试管,并给试管加热片刻,立即看到大量红棕色气体产生。认为该气体一定是溶解在溶液中的NO2,但也有同学持有异议。请分析原因 。
方案二:用双氧水和二氧化锰制得氧气,并把氧气缓缓通入绿色溶液中,观察溶液颜色变为蓝色。请用方程式表示溶液颜色变化的反应原理__________ ____________。
方案三:往蓝色溶液中缓缓通入NO2气体,溶液颜色变绿色。
③从环保的角度看,你认为三个方案中最好的是哪一个 。
(13分)某研究性学习小组设计不同实验方案来研究硝酸的性质。
(1)甲组同学设计下图装置来证实稀硝酸与铜反应,步骤如下。
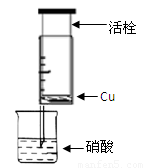
A、检验50ml针筒的气密性。
B、抽出活栓,往针筒内放入一小块铜片,把针筒活栓推到底,将针筒下端玻璃管浸入蒸馏水中,抽拉活栓,吸入约10mL蒸馏水,发现针筒内仍有空气,然后 。
C、将针筒下端玻璃管浸入浓硝酸中,抽拉活栓,缓缓吸入4mL浓硝酸,将针筒下端套上橡皮管,然后用铁夹夹住。
回答以下相关问题:
①B中应补充的操作是 。
②一段时间后在针筒内观察到溶液颜色为蓝色,有 色气体产生。该反应的离子方程式为 。
③反应停止后,针筒内产生了气体,要验证产生的气体是NO,还需进一步进行的操作是 。
(2)乙组同学也用此装置直接抽取浓硝酸和铜反应,发现溶液是绿色的,为了探究绿色的原因,乙组同学又做了三组对比实验,具体如下:
|
组 |
m(Cu)/g |
硝酸(过量) |
溶液颜色 |
|
A |
1 |
浓HNO3(4mL) |
溶液为绿色 |
|
1 |
稀HNO3(4mL) |
溶液为蓝色 |
|
|
B |
0.5 |
浓HNO3(4mL) |
溶液为绿色 |
|
1 |
稀HNO3(4mL) |
溶液为蓝色 |
|
|
C |
2 |
浓HNO3(4mL) |
溶液为绿色 |
|
1 |
稀HNO3(4mL) |
溶液为蓝色 |
根据乙组同学三组对比实验回答问题:
①一种观点认为:这可能是Cu2+浓度差异的结果,你同意这种看法吗?(填“同意”或“不同意”)__________,原因是 。(结合表格信息加以阐述)
②另一种观点认为:溶液呈绿色是铜与浓硝酸反应时产生的NO2溶于过量浓硝酸显黄色,加上和蓝色的硝酸铜溶液混在一起,使溶液呈绿色。为了验证推断是否正确, 三位同学分别设计了三种方案,并进行验证:
方案一:将绿色溶液转移至试管,并给试管加热片刻,立即看到大量红棕色气体产生。认为该气体一定是溶解在溶液中的NO2,但也有同学持有异议。请分析原因 。
方案二:用双氧水和二氧化锰制得氧气,并把氧气缓缓通入绿色溶液中,观察溶液颜色变为蓝色。请用方程式表示溶液颜色变化的反应原理__________ ____________。
方案三:往蓝色溶液中缓缓通入NO2气体,溶液颜色变绿色。
③从环保的角度看,你认为三个方案中最好的是哪一个 。

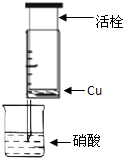 某研究性学习小组设计不同实验方案来研究硝酸的性质.
某研究性学习小组设计不同实验方案来研究硝酸的性质.