题目内容
【题目】在2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O反应中
(1)该反应的氧化剂是 , 氧化产物是
(2)该反应的离子方程式为
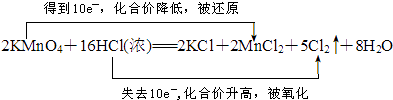
(3)请用“双线桥法”标出该反应电子转移的方向和数目.
(4)该反应氧化剂与还原剂的物质的量之比为 .
【答案】
(1)KMnO4,Cl2
(2)2MnO4﹣+16H+=2Mn2++5Cl2↑+8H2O
(3)
(4)1:5
【解析】解:(1)2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O+2KCl中,Mn元素的化合价降低,KMnO4为氧化剂,Cl元素的化合价升高,被氧化,则氧化产物为Cl2,
所以答案是:KMnO4;Cl2;
(2)2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,离子方程式为:2MnO4﹣+16H+=2Mn2++5Cl2↑+8H2O,
所以答案是:2MnO4﹣+16H+=2Mn2++5Cl2↑+8H2O;
(3)2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中Mn元素化合价降低,被还原,KMnO4为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,反应中Mn得到2×5e﹣,Cl失去10e﹣,电子转移数目和方向可表示  ,
,
所以答案是:  ;
;
(4)反应中,化合价升高是元素是盐酸中的氯元素,所以盐酸是还原剂,16mol的盐酸中只有10mol做还原剂,化合价降低的元素是锰元素,所以高锰酸钾是氧化剂,氧化剂与还原剂的物质的量比为1:5,
所以答案是:1:5.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目


