��Ŀ����
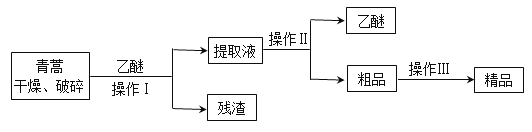
����Ŀ�������أ������ĺ��������Ϊ��ɫ��״���壬�����ڱ�ͪ���ȷºͱ��У��ڼ״����Ҵ������ѡ�ʯ�����п��ܽ⣬��ˮ�м������ܣ��۵�Ϊ156��157�������ȶ��Բ�������Ǹ�Ч�Ŀ�űҩ����֪�����ѷе�Ϊ35��������������ȡ�����صķ���֮һ������ȡԭ��Ϊ�����ģ���Ҫ�����ѽ�ȡ�������ͽ�ȡ�������ѽ�ȡ������Ҫ����Ϊ��
��ش��������⣺
����������и��������Ŀ���� ��
������I��Ҫ�IJ���������Ҫ�У��ձ���©���� ���������������� ��
������������Ҫ���̿�����_____________������ĸ����
A����ˮ�ܽ⣬����Ũ������ȴ�ᾧ
B����95�����Ҵ���Ũ�����ᾧ������
C���������ѽ�����ȡ��Һ
��������ʵ��װ�òⶨ�����ط���ʽ�ķ������£�
��28.2g��������Ʒ����Ӳ�ʲ�����C�У�����ͨ����������Ӻ��ٳ��ȼ�գ���ȷ�ⶨװ��E��Fʵ��ǰ��������������������ݼ��㡣
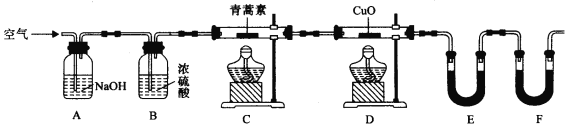
��װ��E��ʢ�ŵ������� ��
����ʵ��װ�ÿ��ܻ��������ɲⶨ������ƫ�ͣ��Ľ������� ��
���ú����Ľ����װ�ý������飬�Ƶã�
װ�� | ʵ��ǰ/g | ʵ���/g |
E | 22.6 | 42.4 |
F | 80.2 | 146.2 |
���������ص����ʽ�� ��
��ijѧ���������ص����ʽ���̽�����������ؼ��뺬��NaOH����̪��ˮ��Һ�У������ص��ܽ�����С�����Ȳ����裬�����ص��ܽ�����������Һ��ɫ��dz��˵���������� ������ĸ��������ͬ�����ʡ�
A���Ҵ� B������ C���������� D��������
���𰸡� (1)���������������ѵĽӴ��������������صĽ����ʣ�(2)������ ���� (3)B(4) ���Ȼ��� ����װ��F������һ����ֹ�����еĶ�����̼��ˮ��������F��װ�ã���C15H22O5 ��C
��������
�������������������и���������������������������ѵĽӴ�����������������صĽ�����������������Ҫ�IJ���������Ҫ�У��ձ���©������������������Ϊ�л�������������У����ö��߷е㲻ͬ������������룻�����������֪����Ʒ�м����95�����Ҵ���Ũ�����ᾧ�����ˣ����ɵõ���Ʒ��������������ȫȼ�����ɶ�����̼��ˮ��ˮ�ȱ��Ȼ������գ�������̼����ʽ�����գ���ȷ�ⶨװ��E��Fʵ��ǰ��������������������ݼ��㡣����ʽ�����տ����Ķ�����̼��ˮ�������������̼�IJⶨ��ֵƫ����װ��F������һ����ֹ�����еĶ�����̼��ˮ��������F��װ�ã� ��������һ��װ�м�ʽ��Fװ�ã��������ص�Ħ������ΪM, 28.2g�����ص���Ϊ28.2/M mol ;E��ˮ����Ϊ��42.4-22.6��/18=1.1mol F�ж�����̼����Ϊ��146.2-80.2��/44=1.5mol ����������ֵ��ϵ��1mol�������к�����ԭ�Ӹ���Ϊ28.2/M��N(H)= 1.1��2; 1mol�������к���̼ԭ�Ӹ���Ϊ28.2/M��N(C)= 1.5��1; N(H): N(C)=22:15; ���������غ���ɣ�28.2=m(C)+m��H��+m(O); 28.2=1.5��12+1.1��2+m(O); m(O)=8g = 8/16=0.5mol; ��ˣ�N(H): N(C) ��N(O) =22:15:5;����ʽΪC15H22O5�������������ڼ�������������Һ�з���ˮ�ⷴӦ�������������ƣ���Һ���Լ�������̪��ɫ��˵���������к���������

