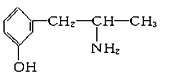
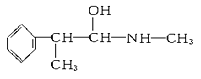
题目内容
【题目】铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第IB族。元素基态原子3d能级上有__________种不冋运动状态的电子;Cu2+的核外电子排布式为______________________
(2)下图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为__________。

(3)胆矾CuSO4·5H2O可写成[Cu(H2O)]SO4·H2O,其结构示意图如图,下列说法正确的是______(填字母)。

A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)S、H、O三种元素的电负性由小到大的顺序是________________。
(5)往硫酸铜溶液中加入过量氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解,得到深蓝色透明溶液,可生成[Cu(NH3)4]2+配离子。写出沉淀转化为深蓝色溶液的的离子方程式__________________;已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是_______________________。
(6)Cu2O的熔点比Cu2S的____________(填“高”或“低”),请解释原因____________________。
【答案】 10 ls22s22p63s23p63d9 或[Ar]3d9 4 BD H S O Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O或 Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH- F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子。 高 Cu2O与Cu2S相比,阳离子相同、阴离子所带电荷也相同,但O2-的半径比S2-小,所以Cu2O的晶格能更大,熔点更高。
【解析】(1)Cu的基态电子排布式为:[Ar]3d104s1,元素基态原子3d能级上有10种不冋运动状态的电子;Cu2+的过程中,参与反应的电子是最外层的4s及3d上各一个电子,故Cu2+离子的电子排布式是为:[Ar]3d9或1s22s22p63s23p63d9;(2)从图中可以看出阴离子在晶胞有四类:顶点(8个)、棱上(4个)、面上(2个)、体心(1个),根据立方体的分摊法,可知该晶胞中阴离子数目为:8×![]() +4×
+4×![]() +2×
+2×![]() +1=4;(3)A、在上述结构示意图中,所有氧原子都是饱和氧原子,所以都采用sp3杂化,选项A正确;B、在上述结构示意图中,存在O→Cu配位键,H-O、S-O共价键和Cu、O离子键,选项B正确;C、胆矾是五水硫酸铜,胆矾是由水合铜离子及硫酸根离子构成的,属于离子晶体,选项C错误;D、由于胆矾晶体中水两类,一类是形成配体的水分子,一类是形成氢键的水分子,结合上有着不同,因此受热时也会因温度不同而得到不同的产物,选项D正确。答案选ABD;(4)元素的非金属性越强,电负性越大,S、H、O三种元素的电负性由小到大的顺序是:H、S、O;(5)沉淀Cu(OH)2转化为深蓝色溶液的的离子方程式:Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O或Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;N、F、H三种元素的电负性:F>N>H,所以NH3中共用电子对偏向N,而在NF3中,共用电子对偏向F,偏离N原子,故答案为:F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子(或者N、F、H三种元素的电负性:F>N>H,在NF3中,共用电子对偏向F,偏离N原子使得氮原子上的孤对电子难于与Cu2+形成配位键。);(6)由于氧离子的离子半径小于硫离子的离子半径,所以亚铜离子与氧离子形成的离子键强于亚铜离子与硫离子形成的离子键,所以Cu2O的熔点比Cu2S的高。
+1=4;(3)A、在上述结构示意图中,所有氧原子都是饱和氧原子,所以都采用sp3杂化,选项A正确;B、在上述结构示意图中,存在O→Cu配位键,H-O、S-O共价键和Cu、O离子键,选项B正确;C、胆矾是五水硫酸铜,胆矾是由水合铜离子及硫酸根离子构成的,属于离子晶体,选项C错误;D、由于胆矾晶体中水两类,一类是形成配体的水分子,一类是形成氢键的水分子,结合上有着不同,因此受热时也会因温度不同而得到不同的产物,选项D正确。答案选ABD;(4)元素的非金属性越强,电负性越大,S、H、O三种元素的电负性由小到大的顺序是:H、S、O;(5)沉淀Cu(OH)2转化为深蓝色溶液的的离子方程式:Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O或Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;N、F、H三种元素的电负性:F>N>H,所以NH3中共用电子对偏向N,而在NF3中,共用电子对偏向F,偏离N原子,故答案为:F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子(或者N、F、H三种元素的电负性:F>N>H,在NF3中,共用电子对偏向F,偏离N原子使得氮原子上的孤对电子难于与Cu2+形成配位键。);(6)由于氧离子的离子半径小于硫离子的离子半径,所以亚铜离子与氧离子形成的离子键强于亚铜离子与硫离子形成的离子键,所以Cu2O的熔点比Cu2S的高。

 阅读快车系列答案
阅读快车系列答案【题目】某化学研究性学习小组对铜及铜的部分化合物的性质进行实验探究,研究的问题和过程如下:
I.氯化铜的制备
该研究性小组在实验室里用下列仪器和药品来制取纯净的无水氯化铜:
序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
仪器及装置图 |
|
|
|
|
|
|
图中A、B、C、D、E、F的虚线部分表示玻璃管接口,接口的弯曲和伸长等部分未画出。根据要求填写下列各小题空白:
(1)如果所制气体从左向右流动时,上述各仪器装置的正确连接顺序是(填各装置的序号)_____接_____接_____接_____接_____接;
(2)装置④的作用是_____________________;
(3)在装置⑤的烧瓶中,发生反应的化学方程式为_____________________;
Ⅱ.探究Cu(OH)2是否和Al(OH)3一样具有两性
(4)该研究性学习小组取适量实验I中制得的产品氯化铜固体充分溶解在一定浓度的盐酸中,过滤,得氯化铜溶液;为探究Cu(OH)2是否和Al(OH)3一样具有两性,除选择配制的CuCl2溶液外,还需要一定选用的试剂为________________;(填序号)
a.氨水 b.氢氧化钠溶液 c.稀硫酸 d.冰醋酸
Ⅲ.为探究不同价态铜的稳定性
(5)该研究性学习小组用实验Ⅱ中所获得的氢氧化铜沉淀制得氧化铜粉末,然后将CuO粉末加热至1000℃以上完全分解成红色的Cu2O粉末,该实验说明:在高温条件下,+l价的Cu比+2价Cu更________(填“稳定”或“不稳定”).
(6)向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子化学方程式为___________;