题目内容
【题目】某锂-空气电池放电时的工作原理如图所示。下列叙述正确的是( )
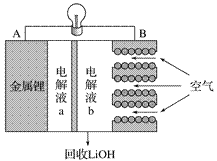
A. 放电时电子由B极经导线向A极移动
B. 电池放电时B电极的反应式为O2 +2H2O + 4e-===4OH -
C. 电解液a、b之间可采用阴离子交换膜
D. 当A电极消耗14g金属锂时,B电极有标况下22.4L氧气参与反应
【答案】B
【解析】
A、在原电池中,A是负极,B是正极,电子由A极经导线向B极移动,故A错误;
B、原电池放电时B电极发生还原反应:O2 +2H2O + 4e-===4OH -,故B正确;
C、根据图示,LiOH由正极区流出,说明电解液a、b之间可采用阳离子交换膜,故C错误;
D、14g金属锂物质的量为1mol,转移电子为1mol; B电极极反应为:O2 +2H2O + 4e-===4OH -,标况下0.25×22.4=5.6L氧气参与反应,故D错误;,
综上所述,本题选B。

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D