题目内容
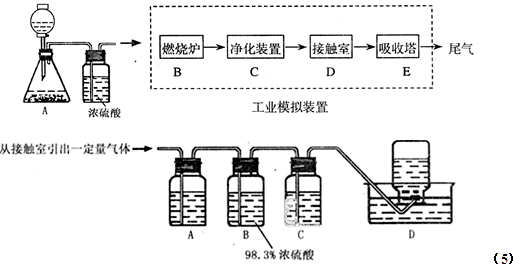
某化学兴趣小组的同学用图所示实验装置进行实验研究(图中a、b、c表示止水夹),对其方案进行研究或评价.

(1)利用实验室常用方法制取氯气,将A、C、E相连,在丙中加入适量水,即可制得氯水,将所得氯水分为两份,进行I、Ⅱ两个实验,探究氯气的有关性质,实验操作、现象、结论如下:
请你评价:
①实验I推出相应结论是否合理?
②实验:Ⅱ推出相应的结论是否合理?
(2)A、C、E相连,可设计一个简单的实验,以验证Cl-和Br-的还原性强弱.A中反应的离子方程式为:

(1)利用实验室常用方法制取氯气,将A、C、E相连,在丙中加入适量水,即可制得氯水,将所得氯水分为两份,进行I、Ⅱ两个实验,探究氯气的有关性质,实验操作、现象、结论如下:
| 实验 | 实验操作 | 现象 | 结论 |
| I | 将氯水滴入品红溶液 | 品红溶液褪色 | 氯气与水反应的产物具有漂白性 |
| Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应的产物具有酸性 |
①实验I推出相应结论是否合理?
不合理
不合理
.若不合理,请说明理由(若合理,则无需填写下行):没有事先证明干燥的氯气无漂白性
没有事先证明干燥的氯气无漂白性
.②实验:Ⅱ推出相应的结论是否合理?
不合理
不合理
若不合理,请说明改进方法(若合理,无需填写下行):应先通过饱和食盐水除去HCl,然后在制备氯水进行实验
应先通过饱和食盐水除去HCl,然后在制备氯水进行实验
.(2)A、C、E相连,可设计一个简单的实验,以验证Cl-和Br-的还原性强弱.A中反应的离子方程式为:
MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O
MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O
,C中应放入的试剂是KBr或NaBr
KBr或NaBr
.分析:(1)验证氯气与水反应的产物具有漂白性应首先排除干燥氯气的影响,需要进行对比实验;
(2)制取的氯气中含有HCl气体,HCl溶于水后能与碳酸氢钠粉末反应产生气泡;
(3)A、C、E相连即为二氧化锰和浓盐酸反应制取氯气,氯气的氧化性强于溴,氯气可以将溴从其盐溶液中置换出来.
(2)制取的氯气中含有HCl气体,HCl溶于水后能与碳酸氢钠粉末反应产生气泡;
(3)A、C、E相连即为二氧化锰和浓盐酸反应制取氯气,氯气的氧化性强于溴,氯气可以将溴从其盐溶液中置换出来.
解答:解:(1)①没有事先证明干燥的氯气无漂白性,则不能证明氯气与水反应的产物是否具有漂白性,
故答案为:不合理;没有事先证明干燥的氯气无漂白性;
②浓盐酸易挥发,制取的氯气中含HCl能与NaHCO3反应产生气体,如要证明氯气与水反应的产物具有酸性,必须先除去HCl,可通入饱和食盐水除杂,
故答案为:不合理;制取的氯气中含HCl能与NaHCO3反应产生气体,应先通过饱和食盐水除去HCl,然后在制备氯水进行实验;
(2)氯气的制取原理方程式为MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O,氯气的氧化性强于溴,氯气可以将溴从其盐溶液中置换出来,涉及的反应为Cl2+2Br-═2Cl-+Br2,可用KBr或NaBr,
故答案为:MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O;KBr或NaBr.
故答案为:不合理;没有事先证明干燥的氯气无漂白性;
②浓盐酸易挥发,制取的氯气中含HCl能与NaHCO3反应产生气体,如要证明氯气与水反应的产物具有酸性,必须先除去HCl,可通入饱和食盐水除杂,
故答案为:不合理;制取的氯气中含HCl能与NaHCO3反应产生气体,应先通过饱和食盐水除去HCl,然后在制备氯水进行实验;
(2)氯气的制取原理方程式为MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O,氯气的氧化性强于溴,氯气可以将溴从其盐溶液中置换出来,涉及的反应为Cl2+2Br-═2Cl-+Br2,可用KBr或NaBr,
故答案为:MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O;KBr或NaBr.
点评:本题考查实验方案的评价,题目难度不大,考查学生分析和解决问题的能力,本题易错点为(1),注意氯气、HClO的性质的异同.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目