题目内容
【题目】置换反应的通式可用如图表示,单质甲、乙和化合物A、B为中学常见物质,请回答下列问题: 
(1)若化合物A常温下呈液态,化合物B的焰色反应呈黄色,则该反应的离子反应方程式为
(2)工业上利用置换反应原理制备一种半导体材料,写出该反应的化学方程式
(3)若气体单质乙能在空气中燃烧,化合物B为黑色磁性晶体,写出该反应的化学方程式 .
【答案】
(1)2Na+2H2O=2Na++2OH﹣+H2↑
(2)SiO2+2C ![]() Si+2CO↑
Si+2CO↑
(3)3Fe+4H2O(g) ![]() Fe3O4+4H2
Fe3O4+4H2
【解析】解:(1)若化合物A常温下呈液态,化合物B的焰色反应呈黄色,A为水,甲为Na,生成B为NaOH,该反应的离子反应方程式为2Na+2H2O=2Na++2OH﹣+H2↑,
所以答案是:2Na+2H2O=2Na++2OH﹣+H2↑;(2)工业上利用置换反应原理制备一种半导体材料,为C与二氧化硅反应生成Si、CO,该反应为SiO2+2C ![]() Si+2CO↑,
Si+2CO↑,
所以答案是:SiO2+2C ![]() Si+2CO↑;(3)若气体单质乙能在空气中燃烧,化合物B为黑色磁性晶体,B为四氧化三铁,则甲为Fe,A为水蒸气,该反应为3Fe+4H2O(g)
Si+2CO↑;(3)若气体单质乙能在空气中燃烧,化合物B为黑色磁性晶体,B为四氧化三铁,则甲为Fe,A为水蒸气,该反应为3Fe+4H2O(g) ![]() Fe3O4+4H2,
Fe3O4+4H2,
所以答案是:3Fe+4H2O(g) ![]() Fe3O4+4H2.
Fe3O4+4H2.

【题目】三氯氢硅(SiHCl3)是生产多晶硅的主要原料.由粗硅制三氯氢硅的反应如下:
反应的热化学方程式 | 平衡常数(300℃) | |
主反应 | Si(s)+3HCl(g)SiHCl3(g)+H2(g)△H=﹣210kJmol﹣1 | K1(molL﹣1)﹣1 |
副反应 | Si(s)+4HCl(g)SiHCl4(g)+2H2(g)△H=﹣240kJmol﹣1 | K2(molL﹣1)﹣1 |
回答下列问题:
(1)写出SiHCl3的结构式 .
(2)SiHCl3 , 在NaOH溶液中剧烈反应放出H2 , 该反应的化学方程式为 .
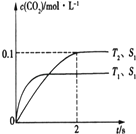
(3)硅的平衡转化率与投料比 ![]() 的关系如图,则图中温度T1、T2、T3的大小顺序为 .
的关系如图,则图中温度T1、T2、T3的大小顺序为 . 
(4)平衡时, ![]() 的值a随着
的值a随着 ![]() 的值b的变化而变化.则
的值b的变化而变化.则 ![]() =(用含Kl、K2的代数式表示);根据关系式,工业上用H2适当稀释HCl来提高SiHCl3的纯度. 请用平衡移动原理加以解释 .
=(用含Kl、K2的代数式表示);根据关系式,工业上用H2适当稀释HCl来提高SiHCl3的纯度. 请用平衡移动原理加以解释 .
(5)也可用H2还原SiCl4来制取SiHCl3 . 300℃时该反应的热化学方程式为 .