题目内容
【题目】
(1)配制溶液时,一般可以分为以下几个步骤:
①称量②计算③溶解④摇匀⑤转移⑥洗涤
⑦定容⑧冷却⑨摇动
其正确的操作顺序为②①③⑧⑤⑥⑤。本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、。
(2)要完成本实验该同学应称出________gNaOH。
(3)使用容量瓶前必须进行的一步操作是________。
(4)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是________。
A.转移溶液时不慎有少量洒到容量瓶外面 |
B.定容时俯视刻度线 |
C.未冷却到室温就将溶液转移到容量瓶并定容 |
D.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线 |
【答案】(1)⑨⑦④;250ml容量瓶;
(2)10.0;
(3)检查是否漏水;
(4)BC
【解析】试题分析:(1)配制1.0mol/L的NaOH溶液的操作步骤为:计算、称量、溶解、冷却、转移、洗涤、摇动、定容、摇匀,所以正确操作顺序为:②①③⑧⑤⑥⑨⑦④;在烧杯中溶解氢氧化钠固体,并用玻璃棒搅拌,加速溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤2-3次,并将洗涤液移入250ml的容量瓶,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所有本实验必须用到的仪器除了天平、药匙、玻璃棒、烧杯还需要250mL容量瓶、胶头滴管;故答案为:⑨⑦④;250mL容量瓶;(2)需要的氢氧化钠的质量m=n×M=C×V×M=1.0mol/L×0.25L×40g/mol=10.0g;故答案为:10.0;
(3)因为配置溶液过程需要颠倒摇匀,所以容量瓶在使用前必须检查是否漏水;故答案为:检查是否漏水;(4)根据c=![]() ,操作中若使n偏小,或者V偏大,则c=
,操作中若使n偏小,或者V偏大,则c=![]() 偏小,配得的溶液浓度偏小;若使n偏大或者V偏小,则配得的溶液浓度偏大。A.转移溶液时不慎有少量洒到容量瓶外面,则实际转移到容量瓶内的氢氧化钠的物质的量减少,根据c=
偏小,配得的溶液浓度偏小;若使n偏大或者V偏小,则配得的溶液浓度偏大。A.转移溶液时不慎有少量洒到容量瓶外面,则实际转移到容量瓶内的氢氧化钠的物质的量减少,根据c=![]() 可知,溶液的浓度偏低;B.定容时俯视刻度线,导致加到容量瓶中的蒸馏水偏少,溶液的体积偏小,根据c=
可知,溶液的浓度偏低;B.定容时俯视刻度线,导致加到容量瓶中的蒸馏水偏少,溶液的体积偏小,根据c=![]() 可知,溶液的浓度偏高;C.液体具有热胀冷缩的性质,氢氧化钠溶解放出大量的热,未冷却到室温就将溶液转移到容量瓶并定容,会导致溶液体积偏小,根据c=
可知,溶液的浓度偏高;C.液体具有热胀冷缩的性质,氢氧化钠溶解放出大量的热,未冷却到室温就将溶液转移到容量瓶并定容,会导致溶液体积偏小,根据c=![]() 可知,溶液浓度偏高;
可知,溶液浓度偏高;
D.定容后塞上瓶塞反复倒转摇匀后液面下降,一部分溶液附着在瓶塞或者容量瓶刻度线以上的瓶壁上,若再加蒸馏水至刻度线,导致溶液体积偏大,根据c=![]() 可知,溶液浓度偏低;故答案为:BC。
可知,溶液浓度偏低;故答案为:BC。

【题目】实验室用右图装置完成下表所列的四个实验,不能达到实验目的是
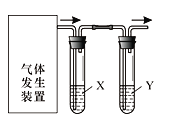
选项 | 实验目的 | 试剂X | 试剂Y |
A | 验证C2H5OH与浓H2SO4加热至170℃制得的乙烯的性质 | NaOH溶液 | Br2水 |
B | 检验FeSO4受热分解产生的气体中有SO3和SO2 | BaCl2溶液 | 品红溶液 |
C | 验证电石与饱和食盐水反应生成的乙炔的性质 | CuSO4溶液 | KMnO4溶液 |
D | 验证氧化性:Cl2>Br2>I2 | NaBr溶液 | KI溶液 |
