题目内容
托盘天平两盘内的小烧杯中,分别盛有足量的稀硫酸,此时天平平衡.向两烧杯中分别加入0.1mol两种金属中的各一种,充分反应后,天平仍保持平衡,则两种金属应分别是
- A.Mg和Al
- B.Fe和Al
- C.Mg和Na
- D.Fe和Cu
C
分析:向两烧杯中分别加入0.1mol两种金属中的各一种,充分反应后,天平仍保持平衡,说明加入金属的质量与生成氢气的质量差相等,即加入金属反应后烧杯内物质质量增加值相等,可分别写出反应的化学方程式或关系式,利用差量法计算.
解答:向两烧杯中分别加入0.1mol以上金属,烧杯内物质质量分别增加的数值可由以下计算判断(设烧杯增加的质量为△m)
Mg~H2 △m
2.4g 0.2g 2.2g
Al~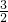 H2 △m
H2 △m
2.7g 0.3g 2.4g
Fe~H2 △m
5.6g 0.1g 5.5g
Na~ H2 △m
H2 △m
2.3g 0.1g 2.2g
加入0.1mol铜与酸不反应,烧杯增加的质量为铜的质量,为6.4g.
由以上分析可知,加入不同的金属,反应后Mg和Na反应后烧杯增加的质量相等,天平仍保持平衡.
故选C.
点评:有关涉及托盘天平平衡的计算题,是高考常考题例,要正确书写出相应的方程式,根据差量法进行相关计算
分析:向两烧杯中分别加入0.1mol两种金属中的各一种,充分反应后,天平仍保持平衡,说明加入金属的质量与生成氢气的质量差相等,即加入金属反应后烧杯内物质质量增加值相等,可分别写出反应的化学方程式或关系式,利用差量法计算.
解答:向两烧杯中分别加入0.1mol以上金属,烧杯内物质质量分别增加的数值可由以下计算判断(设烧杯增加的质量为△m)
Mg~H2 △m
2.4g 0.2g 2.2g
Al~
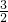 H2 △m
H2 △m2.7g 0.3g 2.4g
Fe~H2 △m
5.6g 0.1g 5.5g
Na~
 H2 △m
H2 △m2.3g 0.1g 2.2g
加入0.1mol铜与酸不反应,烧杯增加的质量为铜的质量,为6.4g.
由以上分析可知,加入不同的金属,反应后Mg和Na反应后烧杯增加的质量相等,天平仍保持平衡.
故选C.
点评:有关涉及托盘天平平衡的计算题,是高考常考题例,要正确书写出相应的方程式,根据差量法进行相关计算

练习册系列答案
相关题目