题目内容
【题目】已知:2H2S(g)+O2(g)===S2(s)+2H2O(l) ΔH=-632 kJ·mol-1。右图为H2S燃料电池的示意图。下列说法正确的是( )
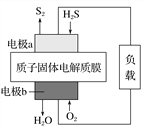
A. 电极a为电池的正极
B. 电极b上发生的电极反应为O2+2H2O+4e-===4OH-
C. 每有1 mol氧气参加反应,电池内部吸收632 kJ热能
D. 每34 g H2S参与反应,电路中有2 mol电子通过
【答案】D
【解析】A、由2H2S(g)+O2(g)=S2(s)+2H2O(l)反应,得出负极H2S失电子发生氧化反应,则a为电池的负极,选项A错误;B、正极氧气得电子发生还原反应,所以电极b上发生的电极反应为O2+4H++4e-=2H2O,选项B错误;C、电路中每通过4mol电子,即消耗1mol氧气,但该装置将化学能转化为电能,所以电池内部几乎不放出能量,选项C错误;D、每34g即![]() =1molH2S参与反应,消耗0.5mol氧气,则根据O2+4H++4e-=2H2O,则反应中转移2mol电子,选项D正确。答案选D。
=1molH2S参与反应,消耗0.5mol氧气,则根据O2+4H++4e-=2H2O,则反应中转移2mol电子,选项D正确。答案选D。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案【题目】相同体积、相同氢离子浓度的强酸溶液和弱酸溶液分别跟足量的镁完全反应,下列说法正确的是( )
A.弱酸溶液产生较多的氢气
B.强酸溶液产生较多的氢气
C.两者产生等量的氢气
D.无法比较两者产生氢气的量
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下[已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1]:
2NH3(g) ΔH=-92.4 kJ·mol-1]:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、3 mol H2 | 2 mol NH3 | 4 mol NH3 |
NH3的浓度(mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
下列说法正确的是
A. 2c1>c3 B. a+b=92.4 C. 2p2<p3 D. α1+α3>1
