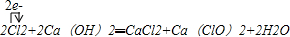题目内容
合理利用化学反应可以造福人类.(1)印刷电路板是由高分子材料和铜箔复合而成,可用FeCl3溶液作“腐蚀剂”刻制印刷电路,写出该过程的离子方程式
(2)次氯酸不稳定,工业上将其制成盐,便于储存和运输,写出工业制取漂白粉的化学方程式
(3)“绿色化学”要求综合考虑经济、技术、环保等方面来设计化学反应路线.若以铜、硫酸为主要原料制取硫酸铜,请你设计复合“绿色化学”思想的反应路线(用化学方程式表示).
分析:(1)Fe3+与Cu反应发生氧化还原反应;
(2)工业上用氯气和消石灰反应制取漂白粉;
(3)根据“绿色化学”的理念设计反应路线,反应中不能生成有毒的气体,还要价格低廉.
(2)工业上用氯气和消石灰反应制取漂白粉;
(3)根据“绿色化学”的理念设计反应路线,反应中不能生成有毒的气体,还要价格低廉.
解答:解:(1)Fe3+与Cu反应发生氧化还原反应,反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;,
(2)将氯气通入冷的消石灰中即制得以次氯酸钙为有效成分的漂白粉:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(3)“绿色化学”的理念是经济、技术、环保,铜直接和浓硫酸反应生成硫酸铜,但同时生成二氧化硫,二氧化硫有毒,不符合“绿色化学”的理念;硫酸是酸,能和金属氧化物反应生成盐,所以先把铜转化成氧化铜,氧化铜再和稀硫酸反应生成硫酸铜,即2Cu+O2
2CuO,CuO+H2SO4=CuSO4+H2O,
故答案为:2Cu+O2
2CuO、CuO+H2SO4=CuSO4+H2O.
(2)将氯气通入冷的消石灰中即制得以次氯酸钙为有效成分的漂白粉:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(3)“绿色化学”的理念是经济、技术、环保,铜直接和浓硫酸反应生成硫酸铜,但同时生成二氧化硫,二氧化硫有毒,不符合“绿色化学”的理念;硫酸是酸,能和金属氧化物反应生成盐,所以先把铜转化成氧化铜,氧化铜再和稀硫酸反应生成硫酸铜,即2Cu+O2
| ||
故答案为:2Cu+O2
| ||
点评:本题考查铁离子、氯气的性质,侧重于学生的分析能力和元素化合物知识的综合运用的考查,难度不大,注意把握绿色化学的要求.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目