题目内容
【题目】里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·H2O),过程如下:
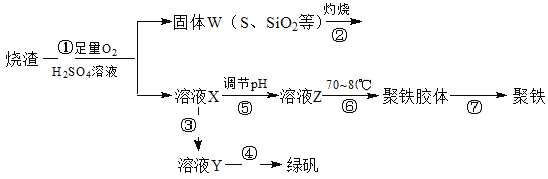
请回答下列问题:
(1)写出过程①中FeS和O2、H2SO4反应的化学方程式:___________________。
(2)将过程②中产生的气体通入下列溶液中,溶液会褪色的是_________。
A.品红溶液 B.紫色石蕊试液 C.酸性高锰酸钾溶液 D.溴水
(3)过程③中,需要加入的物质是_______________(化学式)。
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有_____________。
(5)过程⑥中,将溶液Z加热到70~80℃,目的是:__________________________。
(6)检验X溶液中的金属阳离子,通常使用的试剂和现象是_________________。
【答案】(1) 4FeS+6H2SO4+3O2=2Fe2(SO4)3+6H2O+4S
(2)ACD (3)Fe
(4)蒸发皿 玻璃棒
(5)升高温度,促进铁离子水解
(6)硫氰化钾或KSCN溶液 溶液呈红色
【解析】
试题分析:(1)反应①的反应物为FeS、O2和H2SO4,生成物有S,根据质量守恒还应有Fe2(SO4)3和H2O,
反应的化学方程式为4FeS+6H2SO4+3O2=2Fe2(SO4)3+6H2O+4S。
(2)过程②产生的气体为SO2,具有还原性和漂白性,因具有漂白性而使品红褪色,因具有还原性而使具有氧化性的酸性KMnO4溶液、溴水褪色,答案选ACD;
(3)溶液X中含有Fe3+,要制备绿矾,应加入Fe使之还原为Fe2+,加入铁可生成Fe2+,并且不引入新的杂质,所以加入的物质是Fe(或铁)。
(4)蒸发结晶需要使用酒精灯、三角架、泥三角、还需要的仪器有蒸发皿、玻璃棒。
(5)过程⑥中,将溶液Z加热到70~80℃的目的是升高温度,促进铁离子水解。
(6)溶液X中含有Fe3+,检验铁离子的试剂常用硫氰化钾或KSCN溶液,现象是溶液呈红色。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下表是实验室制备气体的有关内容:
编号 | 实验内容 | 实验原理 | 发生装置 |
① | 制氧气 | H2O2→O2 | |
② | 制氨气 | NH4Cl→NH3 | |
③ | 制氯气 | HCl→Cl2 |
(1)上述气体中:从制备过程看,必须选择合适的氧化剂才能实现的是______________(填气体的化学式,下同);从反应中有无电子转移的角度看,明显不同于其他气体的是___________,写出实验室制取该气体的化学方程式
(2)根据表中所列实验原理,从下列装置中选择合适的发生装置,将其编号填入上表的空格中。

(3) 若用上述制备O2的装置制备NH3,则选择的试剂为____________________。
(4) 制备Cl2需用8 mol/L的盐酸100mL,现用12 mol/L的盐酸来配制。
①需要12 mol/L的盐酸的体积为 mL(精确到0.1 mL)
②在容量瓶的使用方法中,下列操作不正确的是 (填写标号)。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时用量筒量取浓盐酸后用玻璃棒引流入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用胶头滴管滴加蒸馏水直到凹液面的最低处和标线相平
D.定容后盖好瓶塞,用食指顶住,用另一只手手指托住瓶底,把容量瓶倒转和摇动多次