题目内容
根据化学反应速率的计算公式v=Δc/Δt,现有化学反应N2+3H2
| N2 | H2 | NH3 | |
浓度 | 反应开始时 | 1.5 mol·L-1 | 4.5 mol·L-1 | 0 |
10 min后 |
| 4.2 mol·L-1 |
| |
反应速率 | v(H2)=___________________ | |||
v(NH3)=__________________ | ||||
v(H2)=0.03 mol·L-1·min-1
v(NH3)=0.02 mol·L-1·min-1
解析:根据化学反应速率的计算公式可得
v(H2)=![]() =0.03 mol·L-1·min-1
=0.03 mol·L-1·min-1
由速率之比等于方程式的化学计量数比可求得
v(NH3)=![]() ×0.03 mol·L-1·min-1=0.02 mol·L-1·min-1
×0.03 mol·L-1·min-1=0.02 mol·L-1·min-1

I.某校化学实验小组探究浓度对化学反应速率的影响,并测定![]() 和KI反应的化学反应速率。进行如下实验探究:
和KI反应的化学反应速率。进行如下实验探究:
【实验原理】
![]() 和KI反应的离子方程式为:
和KI反应的离子方程式为:
![]() (1)
(1)
平均反应速率的计算式为![]() 。
。
实验时,向![]() 、
、![]() 和淀粉指示剂混合溶液中加入
和淀粉指示剂混合溶液中加入![]() 溶液,不断搅拌。在反应(1)进行的同时,发生反应:
溶液,不断搅拌。在反应(1)进行的同时,发生反应:
![]() (2)
(2)
反应(1)生成的![]() 立即与
立即与![]() 反应,生成无色的
反应,生成无色的![]() 和
和![]() 。
。![]() 耗尽时,反应(1)继续生成的
耗尽时,反应(1)继续生成的![]() 才与淀粉作用呈现蓝色。从加入
才与淀粉作用呈现蓝色。从加入![]() 溶液到出现蓝色的时间为
溶液到出现蓝色的时间为![]() 。
。
【实验内容】
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上。
| 实验编号 | ①[来源:Z。xx。k.Com] | ② | ③ | ④ | ⑤ | |
| 试剂[来源:学&科&网Z&X&X 用量 (mL) | 0.20 mol·L | 20.0 | 10.0[ | b | 20.0 | 20.0 |
| 0.20 mol·L | 20.0 | 20.0 | 20.0 | 10.0 | 5.0 | |
| 0.010 mol·L | a | 8.0 | 8.0 | 8.0 | 8.0 | |
| 0.2%淀粉溶液 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | |
| 0.20 mol·L | 0 | 0 | 0 | 10.0 | c | |
| 0.20 mol·L | 0 | 10.0 | 15.0 | 0 | 0 | |
| 20℃时,反应时间 | 32 | 67 | 130 | 66 | 135 | |
| 为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变 | ||||||
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是 。
(3)第①组实验的![]() mol·(L·s)
mol·(L·s)![]() 。
。
(4)根据上表数据分析,可以得到的结论有(写出一条即可) 。
II.实验小组查资料得知,向含有NaCO3的Na2S溶液中通入SO2,可以制备上述实验所需的Na2S2O3。反应如下:
![]()
![]()
![]()
该小组根据上述原理设计如图19所示装置制备![]() 。
。

(1)实验应避免有害气体排放到空气中。装置①、②中盛放的试剂依次是① ;
② 。
(2)实验过程中,随着气体的通入,装置①中有大量黄色固体析出,继续通入气体,可以观察到的现象是 。
(3)反应结束后,从制得的![]() 稀溶液中得到
稀溶液中得到![]() 晶体的主要操作包括: 。
晶体的主要操作包括: 。
I.某校化学实验小组探究浓度对化学反应速率的影响,并测定![]() 和KI反应的化学反应速率。进行如下实验探究:
和KI反应的化学反应速率。进行如下实验探究:
【实验原理】
![]() 和KI反应的离子方程式为:
和KI反应的离子方程式为:
![]() (1)
(1)
平均反应速率的计算式为![]() 。
。
实验时,向![]() 、
、![]() 和淀粉指示剂混合溶液中加入
和淀粉指示剂混合溶液中加入![]() 溶液,不断搅拌。
溶液,不断搅拌。
在反应(1)进行的同时,发生反应:
![]() (2)
(2)
反应(1)生成的![]() 立即与
立即与![]() 反应,生成无色的
反应,生成无色的![]() 和
和![]() 。
。![]() 耗尽时,反应(1)继续生成的
耗尽时,反应(1)继续生成的![]() 才与淀粉作用呈现蓝色。从加入
才与淀粉作用呈现蓝色。从加入![]() 溶液到出现蓝色的时间为
溶液到出现蓝色的时间为![]() 。
。
【实验内容】
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上。
| 实验编号 | ① | ② | ③ | ④ | ⑤ | |
| 试剂 用量 (mL) | 0.20 mol·L | 20.0 | 10.0 | b | 20.0 | 20.0 |
| 0.20 mol·L | 20.0 | 20.0 | 20.0 | 10.0 | 5.0 | |
| 0.010 mol·L | a | 8.0 | 8.0 | 8.0 | 8.0 | |
| 0.2%淀粉溶液 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | |
| 0.20 mol·L | 0 | 0 | 0 | 10.0 | c | |
| 0.20 mol·L | 0 | 10.0 | 15.0 | 0 | 0 | |
| 20℃时,反应时间 | 32 | 67 | 130 | 66 | 135 | |
| 为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变 | ||||||
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是 。
(3)第①组实验的![]() mol·(L·s)
mol·(L·s)![]() 。
。
(4)根据上表数据分析,可以得到的结论有(写出一条即可) 。
II.实验小组查资料得知,向含有NaCO3的Na2S溶液中通入SO2,可以制备上述实验所需的Na2S2O3。反应如下:
![]()
![]()
![]()
该小组根据上述原理设计如图19所示装置制备![]() 。
。

(1)实验应避免有害气体排放到空气中。装置①、②中盛放的试剂依次是① ;② 。
(2)实验过程中,随着气体的通入,装置①中有大量黄色固体析出,继续通入气体,可以观察到的现象是 。
(3)反应结束后,从制得的![]() 稀溶液中得到
稀溶液中得到![]() 晶体的主要操作包括: 。
晶体的主要操作包括: 。
(13分)I.某校化学实验小组探究浓度对化学反应速率的影响,并测定(NH4)2S2O8和KI反应的化学反应速率。进行如下实验探究:
【实验原理】
(NH4)2S2O8和KI反应的离子方程式为:S2O82- + 2I-= 2SO42- + I2 (1)
平均反应速率的计算式为v(S2O82-)= 。
实验时,向KI、Na2S2O3和淀粉指示剂混合溶液中加入(NH4)2S2O8溶液,不断搅拌。
在反应(1)进行的同时,发生反应:2S2O32-+ I2 = S4O62-+ 2I- (2)
反应(1)生成的I2立即与S2O32-反应,生成无色的S4O62-和I-。S2O32-耗尽时,反应(1)继续生成的I2才与淀粉作用呈现蓝色。从加入(NH4)2S2O8溶液到出现蓝色的时间为Δt。
【实验内容】
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上。
| 实 验 编 号 | ① | ② | ③ | ④ | ⑤ | |
|
试剂 用量 (mL) | 0.20 mol·L-1 (NH4)2S2O8溶液 | 20.0 | 10.0 | b | 20.0 | 20.0 |
| 0.20 mol·L-1 KI溶液 | 20.0 | 20.0 | 20.0 | 10.0 | 5.0 | |
| 0.010 mol·L-1 Na2S2O3溶液 | a | 8.0 | 8.0 | 8.0 | 8.0 | |
| 0.2% 淀粉溶液 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | |
| 0.20 mol·L-1KNO3溶液 | 0 | 0 | 0 | 10.0 | c | |
| 0.20 mol·L-1(NH4)2SO4溶液 | 0 | 10.0 | 15.0 | 0 | 0 | |
| 20 ℃时,反应时间Δt(s) | 32 | 67 | 130 | 66 | 135 | |
| 为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变 |
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是 。
(3)第①组实验的v(S2O82-)= mol·(L·s)-1。
(4)根据上表数据分析,可以得到的结论有(写出一条即可)
。
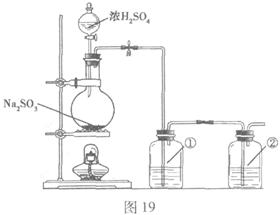
II.实验小组查资料得知,向含有Na2CO3的Na2S溶液中通入SO2,可以制备上述实验所需的Na2S2O3。反应如下:Na2CO3+ SO2= Na2SO3 + CO2;2Na2S + 3SO2= 2Na2SO3 + 3S↓;
Na2SO3 + S= Na2S2O3。该小组根据上述原理设计下图所示装置制备Na2S2O3。
(1)实验应避免有害气体排放到空气中。装置①、②中盛放的试剂依次是
① ;
② 。
(2)实验过程中,随着气体的通入,装置①中有气泡产生,还有大量黄色固体析出,继续通入气体,可以观察到的现象是 。
(3)反应结束后,从制得的Na2S2O3稀溶液中得到Na2S2O3·5H2O晶体的主要操作包括: 。
(13分)I.某校化学实验小组探究浓度对化学反应速率的影响,并测定(NH4)2S2O8和KI反应的化学反应速率。进行如下实验探究:
【实验原理】
(NH4)2S2O8和KI反应的离子方程式为:S2O82- + 2I-= 2SO42- + I2 (1)
平均反应速率的计算式为v(S2O82-)=  。
。
实验时,向KI、Na2S2O3和淀粉指示剂混合溶液中加入(NH4)2S2O8溶液,不断搅拌。
在反应(1)进行的同时,发生反应:2S2O32-+ I2 = S4O62-+ 2I- (2)
反应(1)生成的I2立即与S2O32-反应,生成无色的S4O62-和I-。S2O32-耗尽时,反应(1)继续生成的I2才与淀粉作用呈现蓝色。从加入(NH4)2S2O8溶液到出现蓝色的时间为Δt。
【实验内容】
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上。
|
实 验 编 号 |
① |
② |
③ |
④ |
⑤ |
|
|
试剂 用量 (mL) |
0.20 mol·L-1 (NH4)2S2O8溶液 |
20.0 |
10.0 |
b |
20.0 |
20.0 |
|
0.20 mol·L-1 KI溶液 |
20.0 |
20.0 |
20.0 |
10.0 |
5.0 |
|
|
0.010 mol·L-1 Na2S2O3溶液 |
a |
8.0 |
8.0 |
8.0 |
8.0 |
|
|
0.2% 淀粉溶液 |
2.0 |
2.0 |
2.0 |
2.0 |
2.0 |
|
|
0.20 mol·L-1KNO3溶液 |
0 |
0 |
0 |
10.0 |
c |
|
|
0.20 mol·L-1(NH4)2SO4溶液 |
0 |
10.0 |
15.0 |
0 |
0 |
|
|
20 ℃时,反应时间Δt(s) |
32 |
67 |
130 |
66 |
135 |
|
|
为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变 |
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是 。
(3)第①组实验的v(S2O82-)= mol·(L·s)-1。
(4)根据上表数据分析,可以得到的结论有(写出一条即可)
。
II.实验小组查资料得知,向含有Na2CO3的Na2S溶液中通入SO2,可以制备上述实验所需的Na2S2O3。反应如下:Na2CO3 + SO2= Na2SO3 + CO2;2Na2S + 3SO2 = 2Na2SO3 + 3S↓;
Na2SO3 + S= Na2S2O3。该小组根据上述原理设计下图所示装置制备Na2S2O3。

(1)实验应避免有害气体排放到空气中。装置①、②中盛放的试剂依次是
① ;
② 。
(2)实验过程中,随着气体的通入,装置①中有气泡产生,还有大量黄色固体析出,继续通入气体,可以观察到的现象是 。
(3)反应结束后,从制得的Na2S2O3稀溶液中得到Na2S2O3·5H2O晶体的主要操作包括: 。
I.某校化学实验小组探究浓度对化学反应速率的影响,并测定![]() 和KI反应的化学反应速率。进行如下实验探究:
和KI反应的化学反应速率。进行如下实验探究:
【实验原理】
![]() 和KI反应的离子方程式为:
和KI反应的离子方程式为:
![]() (1)
(1)
平均反应速率的计算式为![]() 。
。
实验时,向![]() 、
、![]() 和淀粉指示剂混合溶液中加入
和淀粉指示剂混合溶液中加入![]() 溶液,不断搅拌。
溶液,不断搅拌。
在反应(1)进行的同时,发生反应:
![]() (2)
(2)
反应(1)生成的![]() 立即与
立即与![]() 反应,生成无色的
反应,生成无色的![]() 和
和![]() 。
。![]() 耗尽时,反应(1)继续生成的
耗尽时,反应(1)继续生成的![]() 才与淀粉作用呈现蓝色。从加入
才与淀粉作用呈现蓝色。从加入![]() 溶液到出现蓝色的时
溶液到出现蓝色的时
间为![]() 。
。
【实验内容】
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上。
| 实验编号 | ①[ | ② | ③ | ④ | ⑤ | |
| 试剂] 用量 (mL) | 0.20 mol·L | 20.0 | 10.0 | b | 20.0 | 20.0 |
| 0.20 mol·L | 20.0 | 20.0 | 20.0 | 10.0 | 5.0 | |
| 0.010 mol·L | a | 8.0 | 8.0 | 8.0 | 8.0 | |
| 0.2%淀粉溶液 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | |
| 0.20 mol·L | 0 | 0 | 0 | 10.0 | c | |
| 0.20 mol·L | 0 | 10.0 | 15.0 | 0 | 0 | |
| 20℃时,反应时间 | 32 | 67 | 130 | 66 | 135 | |
| 为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变 | ||||||
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是 。
(3)第①组实验的![]() mol·(L·s)
mol·(L·s)![]() 。
。
(4)根据上表数据分析,可以得到的结论有(写出一条即可) 。
 II.实验小组查资料得知,向含有NaCO3的Na2S溶液中通入SO2,可以制备上述实验所需的Na2S2O3。反应如下:
II.实验小组查资料得知,向含有NaCO3的Na2S溶液中通入SO2,可以制备上述实验所需的Na2S2O3。反应如下:
![]()
![]()
![]()
该小组根据上述原理设计如图19所示
装置制备![]() 。
。
(1)实验应避免有害气体排放到空气中。
装置①、②中盛放的试剂依次是① ;
② 。
(2)实验过程中,随着气体的通入,装置①中有大量黄色固体析出,继续通入气体,可以观察到的现象是 。
(3)反应结束后,从制得的![]() 稀溶液中得到
稀溶液中得到![]() 晶体的主要操作包括: 。
晶体的主要操作包括: 。