题目内容
(11分)自2010年8月7日,甘肃省舟曲县发生特大泥石流后,各地的救援物资远远不断运往灾区。下图为地方捐助的一种国家准字号补铁补血用药——复方硫酸亚铁叶酸片,其主要成分是绿矾——硫酸亚铁晶体(FeSO4·7H2O)。
Ⅰ、某校课外活动小组为测定该补血剂中铁元素的含量特设计实验步骤如下:
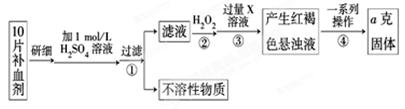
请回答下列问题:
(1)步骤②中加入过量H2O2的目的是 。
(2)步骤③中反应的离子方程式为 。
(3)步骤④中一系列处理的操作步骤是:过滤、 、灼烧、 、称量。
(4)若实验无损耗,则每片补血剂含铁元素的质量为 g(用含a的代数式表示)。
Ⅱ、灾难过后,灾区的饮用水变得非常的浑浊,不能饮用。因此对污染的饮用水的处理成了非常重要的事,其中处理的方法有很多:
(1)可以用适量绿矾和氯气一起作用于污染的自来水,而起到较好的净水效果;理由是(用离子方程式表示) ; ; 。
(2)在使用过程中发现绿矾和氯气的混合使用对酸性废水中的悬浮物处理效果较差,其原因是 。
Ⅰ、某校课外活动小组为测定该补血剂中铁元素的含量特设计实验步骤如下:

请回答下列问题:
(1)步骤②中加入过量H2O2的目的是 。
(2)步骤③中反应的离子方程式为 。
(3)步骤④中一系列处理的操作步骤是:过滤、 、灼烧、 、称量。
(4)若实验无损耗,则每片补血剂含铁元素的质量为 g(用含a的代数式表示)。
Ⅱ、灾难过后,灾区的饮用水变得非常的浑浊,不能饮用。因此对污染的饮用水的处理成了非常重要的事,其中处理的方法有很多:
(1)可以用适量绿矾和氯气一起作用于污染的自来水,而起到较好的净水效果;理由是(用离子方程式表示) ; ; 。
(2)在使用过程中发现绿矾和氯气的混合使用对酸性废水中的悬浮物处理效果较差,其原因是 。
(11分)Ⅰ、(1)将溶液中Fe2+完全转化为Fe3+(1分)
(2)Fe3++3OH-===Fe(OH)3↓或Fe3++3NH3·H2O===Fe(OH)3↓+3NH(2分)
(3)洗涤 冷却(2分)(4)0.07a(2分)
Ⅱ、(1)Cl2+H2O H++Cl―+HClO Cl2+2Fe2+=2Fe3++2Cl- Fe3++3H2O
H++Cl―+HClO Cl2+2Fe2+=2Fe3++2Cl- Fe3++3H2O Fe(OH)3(胶体)+3H+(3分)
Fe(OH)3(胶体)+3H+(3分)
(2)因酸性废液中,将会抑制Fe3+的水解,无法得到Fe(OH)3胶体,故不能够吸附悬浮物(1分)
(2)Fe3++3OH-===Fe(OH)3↓或Fe3++3NH3·H2O===Fe(OH)3↓+3NH(2分)
(3)洗涤 冷却(2分)(4)0.07a(2分)
Ⅱ、(1)Cl2+H2O
 H++Cl―+HClO Cl2+2Fe2+=2Fe3++2Cl- Fe3++3H2O
H++Cl―+HClO Cl2+2Fe2+=2Fe3++2Cl- Fe3++3H2O Fe(OH)3(胶体)+3H+(3分)
Fe(OH)3(胶体)+3H+(3分)(2)因酸性废液中,将会抑制Fe3+的水解,无法得到Fe(OH)3胶体,故不能够吸附悬浮物(1分)
试题分析:Ⅰ、(1)双氧水具有强氧化性,能把亚铁离子氧化生成铁离子,所以加入过量双氧水的目的是将溶液中Fe2+完全转化为Fe3+。
(2)根据生成物是红褐色沉淀可知,X应该是碱液,所以反应的方程式是Fe3++3OH-===Fe(OH)3↓或Fe3++3NH3·H2O===Fe(OH)3↓+3NH。
(3)过滤得到的沉淀必须洗涤,灼烧后的固体必须冷却。
(4)ag固体是氧化铁,所以根据铁原子守恒可知,每片补血剂含铁元素的质量为
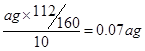 。
。Ⅱ、(1)氯气溶于水生成的次氯酸具有强氧化性,能杀菌消毒。其次氯气还可以把亚铁离子氧化生成铁离子,而铁离子水解生成的氢氧化铁胶体具有吸附性,从而达到净水的目的,有关反应的方程式是Cl2+H2O
 H++Cl―+HClO、Cl2+2Fe2+=2Fe3++2Cl-、Fe3++3H2O
H++Cl―+HClO、Cl2+2Fe2+=2Fe3++2Cl-、Fe3++3H2O Fe(OH)3(胶体)+3H+。
Fe(OH)3(胶体)+3H+。(2)由于在酸性废液中,大量的氢离子会抑制Fe3+的水解,从而无法得到Fe(OH)3胶体,所以不能够吸附悬浮物,效果差。
点评:该题通过补血剂中铁元素含量的测定以及废水的处理等,考查学生对化学实验原理理解、应用,以及分析、推理和灵活运用知识和计算的能力等

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
