题目内容
【题目】某温度下,在2 L密闭容器中投入一定量的A、B,发生反应3A(g)+bB(g) ![]() cC(g)。12 s时达到平衡,生成C的物质的量为0.8 mol,反应过程如图所示。下列说法正确的是
cC(g)。12 s时达到平衡,生成C的物质的量为0.8 mol,反应过程如图所示。下列说法正确的是

A. 前12 s内,A的平均反应速率为0. 025 mol L-1 s-1
B. 12 s后,A的消耗速率等于B的生成速率
C. 化学计量数之比b:c==1:2
D. 反应开始到12 s,A的转化率为70%
【答案】C
【解析】某温度下,在2L密闭容器中投入一定量的A、B发生反应:3A(g)+bB(g)![]() cC(g)△H=-QkJmol-1(Q>0).12s时达到平衡,生成C的物质的量为0.8mol。A.图象分析可知A的浓度变化=0.8mol/L-0.2mol/L=0.6mol/L,反应速率v=
cC(g)△H=-QkJmol-1(Q>0).12s时达到平衡,生成C的物质的量为0.8mol。A.图象分析可知A的浓度变化=0.8mol/L-0.2mol/L=0.6mol/L,反应速率v=![]() =
=![]() =0.05mol/(Ls),故A错误;B.图象分析B的浓度变化=0.5mol/L-0.3mol/L=0.2mol/L,计算B的反应速率=
=0.05mol/(Ls),故A错误;B.图象分析B的浓度变化=0.5mol/L-0.3mol/L=0.2mol/L,计算B的反应速率=![]() =
=![]() ,速率之比等于化学方程式计量数之比,3:b=0.05:
,速率之比等于化学方程式计量数之比,3:b=0.05: ![]() ,b=1,3:c=0.05:
,b=1,3:c=0.05:  ,×100%=2,化学方程式中AB计量数不同,12s后达到平衡状态,A的消耗速率不等于B的生成速率,故B错误;C.图象分析B的浓度变化=0.5mol/L-0.3mol/L=0.2mol/L,计算B的反应速率=
,×100%=2,化学方程式中AB计量数不同,12s后达到平衡状态,A的消耗速率不等于B的生成速率,故B错误;C.图象分析B的浓度变化=0.5mol/L-0.3mol/L=0.2mol/L,计算B的反应速率=![]() =
=![]() ,速率之比等于化学方程式计量数之比,3:b=0.05:
,速率之比等于化学方程式计量数之比,3:b=0.05: ![]() ,b=1,3:c=0.05:
,b=1,3:c=0.05: 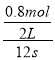 ,c=2,化学计量数之比b:c=1:2,故C正确;D.根据图像,A的转化率
,c=2,化学计量数之比b:c=1:2,故C正确;D.根据图像,A的转化率![]() ×100%=75%,故D错误;故选C。
×100%=75%,故D错误;故选C。

练习册系列答案
相关题目