题目内容
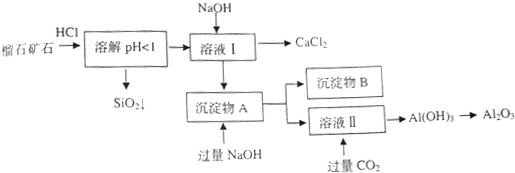
榴石矿石可以看作CaO、Fe2O3、Al2O3、SiO2组成,由榴石矿石制取氯化钙和氧化铝的实验步骤如下:
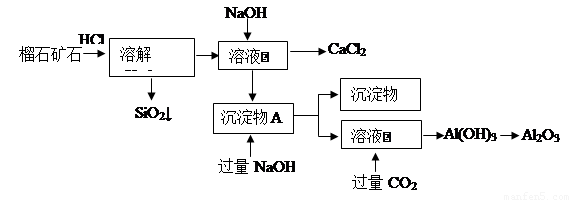
(1)榴石矿加盐酸溶解后,溶液里除了Ca2+外,还含有的金属离子是________。
(2)对溶液Ⅰ进行操作时,控制溶液pH=9~10 (有关氢氧化物沉淀的pH见下表)NaOH不能过量,若NaOH过量可能会导致_________溶解, 沉淀。
|
氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Ca(OH)2 |
|
开始沉淀pH |
1.5 |
3.3 |
12.0 |
(3)写出向沉淀物A中加入过量氢氧化钠溶液的离子方程式 。
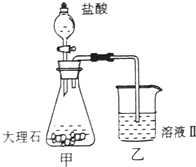
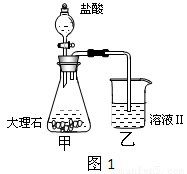
(4)①某同学在实验室中用图1装置制取CO2气体并通入溶液Ⅱ中,结果没有沉淀产生,可能的原是 ;为了能产生沉淀,该同学对图1装置进行了改进,改进的方法为 。
②若将二氧化碳气体通入澄清石灰水中,石灰水变浑浊,混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示该溶解平衡关系 。
(1) Fe3+
Al3+(2)Al(OH)3 Ca(OH)2(3)Al(OH)3+OH-=[Al(OH)4]-(4)①盐酸挥发,制取的二氧化碳中含有盐酸 在甲与乙之间加一盛有饱和碳酸氢钠溶液的洗气瓶②CaCO3(s) Ca2+(aq)+CO32-(aq)
Ca2+(aq)+CO32-(aq)
【解析】
试题分析:榴石矿石中氧化钙、氧化铝、氧化铁与盐酸生成氯化钙、氯化铝、氯化铁,二氧化硅不反应。溶液I中控制pH=9~10,使Fe3+、Al3+完全沉淀,Ca2+不沉淀,若氢氧化钠过量,则氢氧化铝溶解,Ca2+也形成沉淀。沉淀物A为氢氧化铝和氢氧化铁的混合物,加入过量氢氧化钠溶液,氢氧化铝溶解生成偏铝酸钠,氢氧化铁不溶,向偏铝酸钠、氢氧化钠混合溶液中通入过量二氧化碳气体生成氢氧化铝和碳酸氢钠。将大理石与盐酸产生的二氧化碳气体通入偏铝酸钠、氢氧化钠混合溶液中无沉淀产生可能原因是二氧化碳气体中含有大量氯化氢气体,可将产生的气体通过盛有饱和碳酸氢钠溶液的洗气瓶。二氧化碳通入澄清石灰水生成碳酸钙沉淀,CaCO3(s) Ca2+(aq)+CO32-(aq)。
Ca2+(aq)+CO32-(aq)。
考点:化工生产流程图分析 离子方程式的书写 化学实验 沉淀溶解平衡
点评:实验室用石灰石与盐酸制得的二氧化碳气体中混有氯化氢气体和水蒸气,可改用碳酸钠溶液与硫酸溶液反应。

 习题精选系列答案
习题精选系列答案