题目内容
2.下列说法错误的是( )| A. | ⅠA族金属元素是同周期中金属性最强的元素 | |
| B. | ⅤⅡA族元素的阴离子还原性越强,其最高价氧化物对应的水化物的酸性越强 | |
| C. | 主族元素气态氢化物越稳定,其非金属性越强 | |
| D. | 同周期主族元素原子序数越大,其非金属越强 |
分析 A、同一周期元素,元素的金属性随着原子序数的增大而减弱;
B、ⅦA族元素的阴离子还原性越强,元素的非金属越弱;
C、非金属性越强,氢化物越稳定;
D、同一周期,原子序数越大,非金属性越强.
解答 解:A、同一周期元素,元素的金属性随着原子序数的增大而减弱,所以ⅠA族金属元素是同周期中金属性最强的元素,故A正确;
B、ⅦA族元素的阴离子还原性越强,元素的非金属越弱,所以其最高价氧化物对应水化物的酸性越弱,故B错误;
C、非金属性越强,氢化物越稳定,所以元素简单气态氢化物越稳定,则非金属性越强,故C正确;
D、同一周期,随着原子序数增大,元素的非金属性增强,故D正确,
故选B.
点评 本题考查原子结构与元素周期律知识,为高频考点,侧重于学生的分析能力的考查,注意把握元素周期律的递变规律以及比较角度,难度中等.

练习册系列答案
相关题目
13.下列说法正确的是( )
| A. | 元素的价电子数和族序数相等 | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | IA、IIB族的元素属于S区元素 | D. | [Cu(NH3)4]2+离子中的配位键数为3. |
10.2-氯丁烷在NaOH的乙醇溶液中加热反应,下列说法中正确的是 ( )
| A. | 只生成一种有机产物 | B. | 能生成两种有机产物 | ||
| C. | 能生成三种有机产物 | D. | 可能生成烷烃 |
7.亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,常用于水的消毒以及纺织高漂白,过氧化氢法生产亚氯酸钠的流程图如图所示.已知NaClO3的溶解度随温度升高而增大,适当条件下可结晶析出NaClO3•3H2O且NaClO2在碱性条件下稳定性较高,试回答下列问题:
(1)在ClO2发生器中同时有氯气产生,则在发生器中发生反应的化学方程式为2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O.
(2)在NaClO2稳定装置中,H2O2作B(选填序号).
A.氧化剂
B.还原剂
C.既作氧化剂又作还原剂
D.既不作氧化剂也不作还原剂
(3)在实验室模拟“固体分离装置”中的技术,必须进行的实验操作是BEA(按实验先后顺序填写操作代号)
A.过滤 B.加热蒸发 C.分液 D.蒸馏 E.冷却
(4)经查阅资料知道:当PH≤2.0时,ClO2-能被I-完全还原成Cl-;溶液中Na2S2O3能与I2反应:2Na2S2O3+I2=2NaI+Na2S4O6.欲测定成品中NaClO2的含量,现进行如下操作:
①步骤Ⅱ中发生反应的离子方程式是ClO2-+4H++4I-=2I2+Cl-+2H2O.
步骤Ⅲ中达到滴定终点时的现象是滴入最后一滴标准溶液,溶液由蓝色变化为无色且半分钟不变化.
②若上述滴定操作中用去了VmL Na2S2O3溶液,则样品中NaClO2的质量分数$\frac{9.05×1{0}^{-2}VC}{4W}$×100%(用字母表示).
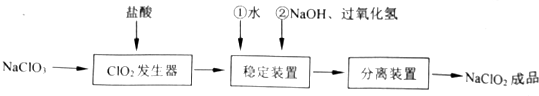
(1)在ClO2发生器中同时有氯气产生,则在发生器中发生反应的化学方程式为2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O.
(2)在NaClO2稳定装置中,H2O2作B(选填序号).
A.氧化剂
B.还原剂
C.既作氧化剂又作还原剂
D.既不作氧化剂也不作还原剂
(3)在实验室模拟“固体分离装置”中的技术,必须进行的实验操作是BEA(按实验先后顺序填写操作代号)
A.过滤 B.加热蒸发 C.分液 D.蒸馏 E.冷却
(4)经查阅资料知道:当PH≤2.0时,ClO2-能被I-完全还原成Cl-;溶液中Na2S2O3能与I2反应:2Na2S2O3+I2=2NaI+Na2S4O6.欲测定成品中NaClO2的含量,现进行如下操作:
| 步骤Ⅰ | 称取样品Wg配成溶液置于锥形瓶中,并调节PH≤2.0 |
| 步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
| 步骤Ⅲ | 用c mol/L的Na2S2O3溶液滴定 |
步骤Ⅲ中达到滴定终点时的现象是滴入最后一滴标准溶液,溶液由蓝色变化为无色且半分钟不变化.
②若上述滴定操作中用去了VmL Na2S2O3溶液,则样品中NaClO2的质量分数$\frac{9.05×1{0}^{-2}VC}{4W}$×100%(用字母表示).

14.下列说法正确的是( )
| A. | 聚氯乙烯的单体是CH2═CHCl | |
| B. | 通过加聚反应得到的聚乙烯属于天然高分子化合物 | |
| C. | 煤的气化是将其通过物理变化转化为气态的过程 | |
| D. | 石油分馏的目的是生产乙烯、丙烯、甲烷等化工原料 |
11.以下对水的利用过程中主要发生了化学变化的是( )
| A. | 水力发电 | B. | 水变成冰 | C. | 水作冷却剂 | D. | 电解水获得氢气 |
12.下列实验设计不能达到实验目的是( )
| 选项 | 实验设计 | 实验目的 |
| A | 过氧化钠与水反应 | 制备少量干燥的氧气 |
| B | 取铁在氧气中充分燃烧后的固体产物溶于稀硫酸,加KSCN溶液 | 检验铁的燃烧产物中含+3价铁 |
| C | 分别取大小相近的钠粒、钾粒投入水中,观察反应的剧烈程度 | 比较钠、钾的还原性强弱 |
| D | 取一定量铝粉分成四等份,一份铝与适量烧碱恰好完全反应,另三份铝与稀硫酸恰好完全反应,再将溶液混合、过滤、洗涤、干燥 | 制备氢氧化铝且原子利用率较高 |
| A. | A | B. | B | C. | C | D. | D |
 .
. .
. .
.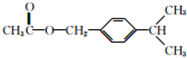 .
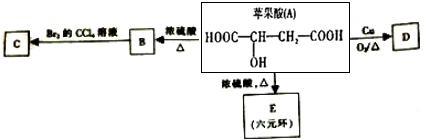
.
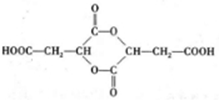 .
. 、
、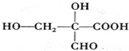 (任一种).
(任一种).