题目内容
10.短周期主族元素X、Y、Z、W原子序数依次增大,X的原子失去一个电子后即为质子,X、Z同主族,Y的原子L层有5个电子,W的单质常温下呈气态.下列说法正确的是( )| A. | 原子半径:r(X)<r(Y)<r(Z)<r(W) | |
| B. | Y的最高价氧化物的水化物酸性比W的强 | |
| C. | Z的一种氧化物可能既含离子键又含共价键 | |
| D. | X、Y、W三种元素一定只能组成共价化合物 |
分析 短周期主族元素X、Y、Z、W原子序数依次增大,X的原子失去一个电子后即为质子,X为H,X、Z同主族,Y的原子L层有5个电子,Y为N,Z为Na,W的单质常温下呈气态,W为Cl,以此来解答.
解答 解:由上述分析可知,X为H,Y为N,Z为Na,W为Cl,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:r(X)<r(Y)<r(W)<r(Z),故A错误;
B.高氯酸为所有含氧酸中酸性最强的酸,则Y的最高价氧化物的水化物酸性比W的弱,故B错误;
C.Z的一种氧化物为过氧化钠时,既含离子键又含共价键,故C正确;
D.X、Y、W三种元素可组成离子化合物氯化铵,故D错误;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素的位置来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
8. 用零价铁(Fe)能去除弱酸性条件下水体中硝酸盐(NO3-),其电化学原理如图所示,下列说法不正确的是( )
用零价铁(Fe)能去除弱酸性条件下水体中硝酸盐(NO3-),其电化学原理如图所示,下列说法不正确的是( )
 用零价铁(Fe)能去除弱酸性条件下水体中硝酸盐(NO3-),其电化学原理如图所示,下列说法不正确的是( )
用零价铁(Fe)能去除弱酸性条件下水体中硝酸盐(NO3-),其电化学原理如图所示,下列说法不正确的是( )| A. | Fe3O4既是负极的氧化产物,也做正极导电材料 | |
| B. | 正极的电极反应式NO3-+10H++8e-=NH4++3H2O | |
| C. | 理论上,Fe增重16g,反应中转移2mol电子 | |
| D. | 反应过程中,溶液的pH值将减小 |
1.下列叙述正确的是( )
| A. | 化学反应中的能量变化主要是由化学键变化引起的 | |
| B. | 铝热反应是放热反应,因此不需要加热就能使反应发生 | |
| C. | 硝酸铵溶于水温度降低,这个变化是吸热反应 | |
| D. | 化学反应中的能量变化的大小与反应物的质量大小无关 |
5.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=7的溶液中:Na+、Fe3+、NO3-、Cl- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、Mg2+、NO3-、SO42- | |
| C. | 能使甲基橙变红色的溶液中:Na+、K+、Cl-、SiO32- | |
| D. | $\frac{{K}_{W}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:Na+、NH4+、CH3COO-、HCO3- |
15.合成氨反应中,下列措施不能加快化学反应速率的是( )
| A. | 升高温度 | B. | 降低温度 | ||
| C. | 增大反应物浓度 | D. | 使用合适的催化剂 |
2.下列有关化学用语使用正确的是( )
| A. | NH4Br的电子式: | |
| B. | S2-的结构示意图: | |
| C. | 比例模型  可以表示甲烷分子,也可以表示四氯化碳分子 可以表示甲烷分子,也可以表示四氯化碳分子 | |
| D. | 丙烷的结构简式为:CH3CHCH3 |
19.下列关于组成表示为CxHy的烷、烯、炔烃的说法不正确的是( )
| A. | 当x≤4 时,常温常压下均为气体 | |
| B. | 一定存在y≤2x+2 | |
| C. | 完全燃烧的通式为CxHy+(x+$\frac{y}{4}$) O2→x CO2+$\frac{y}{2}$ H2O | |
| D. | 等质量的烷、烯、炔烃完全燃烧,碳的质量分数越大耗氧量越多 |
19.下列原子结构示意图表示的元素与 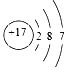 的元素同主族的是( )
的元素同主族的是( )
 的元素同主族的是( )
的元素同主族的是( )| A. |  | B. |  | C. |  | D. |  |