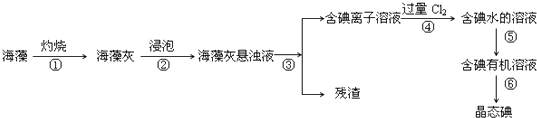
题目内容
【题目】由于燃料电池汽车,尤其氢燃料电池汽车可以实现零污染排放,驱动系统几乎无噪音,且氢能取之不尽、用之不竭,燃料电池汽车成为近年来汽车企业关注的焦点。为了获得竞争优势,各国纷纷出台政策,加速推进燃料电池关键技术的研发。燃料电池的燃料选择有氢气、甲醇等。
(1)二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气合成为甲醇,甲醇是汽车燃料电池的重要燃料。已知氢气、甲醇燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(1) △H=-285kJ/mol ①
CH3OH(l)十![]() O2(g)=CO2(g)+2H2O(1) △H=-726.0 kJ/mol ②
O2(g)=CO2(g)+2H2O(1) △H=-726.0 kJ/mol ②
写出二氧化碳与氢气合成甲醇液体的热化学方程式:________________。
(2)有科技工作者利用稀土金属氧化物作为固体电解质制造出了甲醇-空气燃料电池。这种稀土金属氧化物在高温下能传导O2-。
①这个电池的负极发生的反应是_____________。
②在稀土氧化物的固体电解质中,O2-的移动方向是_____________。
③甲醇可以在内燃机中燃烧直接产生动力推动机动车运行,而科技工作者要花费大量的精力研究甲醇燃料汽车,主要原因是________________。
【答案】 CO2(g)+3H2(g)===CH3OH(l)+H2O(l) ΔH=+298.5 kJ·mol-1 CH3OH+3O2--6e-===CO2↑+2H2O 正极流向负极 燃料电池的能量转化率高
【解析】(1)2H2(g)+O2(g)=2H2O(1) △H=-285kJ/mol ①,CH3OH(l)十![]() O2(g)=CO2(g)+2H2O(1) △H=-726.0 kJ/mol ②,依据盖斯定律①×3-②×2得到:2CO2 (g)+6H2 (g)=2CH3OH(l)+2H2O (l)△H=+597kJ/mol;热化学方程式为:CO2(g)+3H2(g)===CH3OH(l)+H2O(l) ΔH=+298.5 kJ·mol-1;(2)①甲醇一空气燃料电池中氧气得到电子发生还原反应生成氧离子,电极反应为:O2+4e-=2O2-; 甲醇在负极失电子发生氧化反应,电极反应为:CH3OH+3O2--6e-===CO2↑+2H2O;②依据电极反应分析可知原电池中阴离子移向负极,氧离子从正极流向负极移动;③原电池反应实现能量转化的高效率,燃料电池能量转化率高。
O2(g)=CO2(g)+2H2O(1) △H=-726.0 kJ/mol ②,依据盖斯定律①×3-②×2得到:2CO2 (g)+6H2 (g)=2CH3OH(l)+2H2O (l)△H=+597kJ/mol;热化学方程式为:CO2(g)+3H2(g)===CH3OH(l)+H2O(l) ΔH=+298.5 kJ·mol-1;(2)①甲醇一空气燃料电池中氧气得到电子发生还原反应生成氧离子,电极反应为:O2+4e-=2O2-; 甲醇在负极失电子发生氧化反应,电极反应为:CH3OH+3O2--6e-===CO2↑+2H2O;②依据电极反应分析可知原电池中阴离子移向负极,氧离子从正极流向负极移动;③原电池反应实现能量转化的高效率,燃料电池能量转化率高。

 黄冈小状元解决问题天天练系列答案
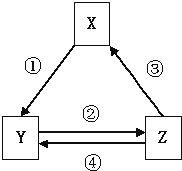
黄冈小状元解决问题天天练系列答案【题目】如表各组物质之间通过一步反应不可以实现如图所示转化关系的是( )
选项 | X | Y | Z | 箭头上所标数字的反应条件 |
A | Na2O2 | NaOH | NaCl | ①常温遇水 |
B | Al2O3 | NaAl(OH)4 | Al(OH)3 | ②通入CO2 |
C | NO | NO2 | HNO3 | ④加入铜粉 |
D | C | CO | CO2 | ③点燃镁条 |
A.A
B.B
C.C
D.D