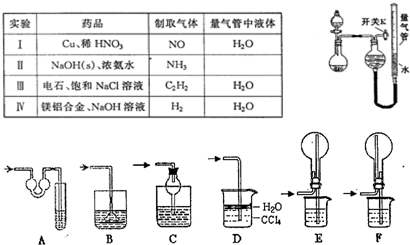
题目内容
为测某镁铝合金样品中铝的含量,进行下列实验:取一定量合金,加入100mL0.3mol·L—1稀硫酸,合金完全溶解,产生的气体在标准状况下体积为560mL;再加0.2mol·L—1NaOH溶液至沉淀质量恰好在此时不再变化,用去350mL NaOH溶液。则所取样品中铝的物质的量为
A.0.005mol B.0.01mol C.0.025mol D.0.03mol
【答案】
B
【解析】
试题分析:根据题意,稀硫酸为0.03mol,氢气为0.025mol,氢氧化钠用去0.07mol,加入氢氧化钠反应如下:
首先发生的反应是中和过量的酸:H++OH-=H2O,
然后是沉淀两种金属离子:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,
最后是Al(OH)3的溶解:Al(OH)3+OH-=[Al(OH)4]-
沉淀的量不再变化,说明Na+最终生成的是Na2SO4为0.03mol,则NaAlO2为0.01mol,Al为0.01mol。
考点:考查镁铝的性质及化学计算。
点评:对于金属参与反应化学计算,一般可采用守恒法计算。

练习册系列答案
相关题目