��Ŀ����
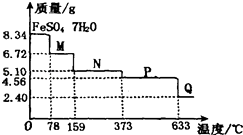
����Ŀ����֪Ba(AlO2)2������ˮ����ͼ��ʾ������Al2(SO4)3��Һ����μ���Ba(OH)2��Һʱ�����ɳ��������ʵ���y�����Ba(OH)2�����ʵ���x�Ĺ�ϵ�������й�������ȷ����

A. a��bʱ���������ʵ�����Al(OH)3��BaSO4��
B. d��eʱ��Һ�����ӵ����ʵ�����Ba2�����ܵ���OH��
C. a��dʱ���������ʵ�����BaSO4����С��Al(OH)3
D. c��dʱ��Һ�����ӵ����ʵ�����AlO2����Ba2����
���𰸡�B
��������A����b��ʱ������ӦAl2(SO4)3+3Ba(OH)2=2Al(OH)3��+3BaSO4�����������ʵ�����Al(OH)3��BaSO4����A����B��d-e���У�ij��ʱ�������Ba(OH)2�����ʵ�������Ba(AlO2)2�����ʵ���ʱ����Һ��Ba2����OH��������ȣ���B��ȷ��C������1molAl2(SO4)3����Һ�к���2molAl3����3molSO42��������Һ����μ���Ba(OH)2��Һʱ�����ķ�ӦΪ��Al3��+3OH��=Al(OH)3����SO42��+Ba2��=BaSO4������2molAl3����ȫ����ʱ������3molBa(OH)2����ʱ3molSO42��ȫ�����������ɳ���Ϊ2molAl(OH)3��3molBaSO4��5mol����ˣ���������Ӧ������BaSO4�����ʵ���ʼ�մ���Al(OH)3�����ʵ�������C����D��c-d������Ӧ2Al(OH)3+Ba(OH)2=Ba(AlO2)2+4H2O��1molBa(AlO2)2�����2molAlO2����1molBa2������AlO2����Ba2���࣬��D����ѡB��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ�����������������Ҫ��������������������й㷺Ӧ�ã����������ж����������γ��������Ҫ���壮������ʵ�����Ʊ����ǹ�ҵ��������������β�����ջ��������dz���Ҫ�����������գ�
��1��ʵ���ҿ���ͭ��Ũ������Ȼ�������������Ʒ�Ӧ��ȡ�������� 
�����������������Ʒ�Ӧ��ȡ��������ϣ���ܿ��Ʒ�Ӧ�ٶȣ���ͼ�п�ѡ�õķ���װ��������д��ĸ����
��2������������������Ʒ�Ӧ��ȡ3.36L����״������������������Ҫ��ȡ��������g������һλС�������������40%�������ƣ��������������������������ƣ����������ȡ����������g ������һλС������
��3��ʵ���Ҷ�������β�������빤ҵ��������Ļ�ѧԭ����ͨ��ʯ�ҩ�ʯ�෨�ͼ�dz��õ���������
ʯ�ҩ�ʯ�෨�����շ�ӦΪSO2+Ca��OH��2��CaSO3��+H2O�����ղ�����������ɹܵ���������������������ӦΪ2CaSO3+O2+4H2O��2CaSO42H2O����������ͼ1��������շ�ӦΪSO2+2NaOH��Na2SO3+H2O������ص����������Ƽ���ǿ�����տ졢Ч�ʸߣ���������ͼ2��
��֪��
�Լ� | Ca��OH��2 | NaOH |
�۸�Ԫ/kg�� | 0.36 | 2.9 |
����SO2�ijɱ���Ԫ/mol�� | 0.027 | 0.232 |
ʯ�ҩ�ʯ�෨�ͼ���ն�������Ļ�ѧԭ����֮ͬ���� �� �ͼ��ȣ�ʯ�ҩ�ʯ�෨���ŵ��� �� ȱ���� ��
��4����ʯ�ҩ�ʯ�෨�ͼ�Ļ����ϣ����һ���Ľ��ġ���ʵ������ѭ��������������������ͼ��ʾ����