题目内容
【题目】I、依据氧化还原反应:2Ag+(aq)+ Cu(s)== Cu2+(aq)+ 2Ag(s)设计的原电池如图所示。请回答下列问题:
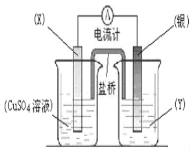
(1)电极X的材料是______;电解质溶液Y是_____。
(2)银电极上发生的电极反应为________; X电极上发生的电极反应为____________。
(3)图中所示连接的盐桥(U型管中装有饱和KNO3溶液)装置,将其放置于电解质溶液中,此时盐桥中的K+移向__________(填“CuSO4溶液”或“Y溶液”),形成闭合回路,构成原电池。
II、如图所示,甲、乙为相互串联的两个电解池。请回答:
(1)甲池若为用电解原理精炼铜的装置,则A电极为________极,电极反应为________。溶液中的c(Cu2+)与电解前相比________(填“变大”、“变小”或“不变”)。
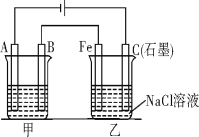
(2)乙池中Fe极电极反应为______________若在乙池中滴入少量酚酞溶液,电解一段时间后,铁极附近呈__________色。
(3)若甲池A极增重12.8 g,则乙池C(石墨)极放出气体在标准状况下的体积为___________。
【答案】铜(Cu) AgNO3溶液 2Ag+ + 2e- = 2Ag Cu - 2e- = Cu2+ Y溶液 阴 Cu2++2e-===Cu 变小 2H++2e-===H2↑或2H2O+2e-=2OH-+H2↑ 红 4.48L
【解析】
I、根据反应2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)分析,在反应中,Cu被氧化,失电子,应为原电池的负极,电极反应为Cu-2e-=Cu2+,则正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e-=Ag,电解质溶液为AgNO3 ,原电池中,电子从负极经外电路流向正极,由此分析解答;
II、(1)依据电解精炼的原理是粗铜做阳极,精铜做阴极,含铜离子的电解质溶液进行电解反应,在阴极是溶液中铜离子得到电子生成铜;
(2)依据装置图分析可知,与电源正极相连的C电极为电解池的阳极,与电源负极连接的A电极是阴极,B为阳极,Fe为阴极;
(3)依据甲池和乙池的转移电子守恒计算甲池和乙池中电极产物的物质的量,据此分析解答。
I、(1)由反应2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)可知,在反应中,Cu被氧化,失电子,应为原电池的负极,Ag+在正极上得电子被还原,电解质溶液为AgNO3,故答案为:铜(Cu);AgNO3溶液;
(2)正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为:Ag++e-=Ag,X电极为负极,其电极反应式为:Cu2e=Cu2+;
(3)盐桥中装有含琼胶的KNO3饱和溶液,则盐桥中 K+移向正极,也就是Y溶液;
II、(1)A与电源负极相连,故A为阴极;电解精炼的原理是粗铜做阳极,精铜做阴极,含铜离子的电解质溶液(CuSO4溶液或CuCl2溶液)进行电解反应,在阴极是溶液中铜离子得到电子生成铜,电极反应是Cu2++2e=Cu;阳极上粗铜中活泼金属先放电,然后是Cu2+放电,而阴极始终是Cu2+得到电子,故电解一段时间后,溶液中c(Cu2+)减小;
(2)依据装置图分析可知,与电源正极相连的C电极为电解池的阳极,与电源负极连接的A电极是阴极,B为阳极,Fe为阴极;Fe电极上是溶液中氢离子得到电子生成氢气,电极反应为2H++2e═H2↑或2H2O+2e-=2OH-+H2↑,破坏水的电离平衡氢氧根离子浓度增大,铁电极附近溶液变红色;
(3)甲池A为电解池的阴极,电极反应为Cu2++2e═Cu,增重12.8g的铜物质的量为0.2mol,转移电子物质的量为0.4mol;乙池C(石墨)极为电解池的阳极,电极反应为:2Cl2e=Cl2↑,依据电子守恒,生成氯气0.2mol,放出气体在标况下的体积为0.2mol×22.4L/mol=4.48L。

【题目】(1)碳酸钠溶液中各离子按照浓度从大到小的顺序依次为: __________________。
(2)下表是几种常见弱酸的电离平衡常数(25℃)
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
①根据分析表格中数据可知,H2CO3、CH3COOH、HClO 三种酸的酸性从强到弱依次是________;下列反应不能发生的是________(填字母)。
a. CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
b. ClO-+CH3COOH=CH3COO-+HClO
c. CO32-+2HClO=CO2↑+H2O+2ClO-
d. 2ClO-+CO2+H2O=CO32-+2HClO
②25℃时, 等浓度的Na2CO3、CH3COONa 和NaClO三种溶液的pH从小到大依次是____________。
(3) 25℃时, Ksp[Mg(OH)2]=5.61×10-12, Ksp[MgF2]=7.42×10-11。 该温度下饱和Mg(OH)2溶液与饱和 MgF2溶液相比, ___________ (填化学式)溶液中的c(Mg2+)大。
(4)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中 c(CH3COO-)-c(Na+)=_________mol·L-1(填计算式,不用求具体值)。
(5)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。稀释后,HX溶液中水电离出来的c(H+)_____ (填“>”、“=”或“<”)醋酸溶液中水电离出来的c(H+);