题目内容
【题目】在0.2L由NaCl、MgCl2、BaCl2组成的混合液中,部分离子浓度大小如右图所示,回答下列问题:
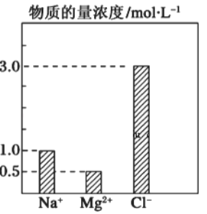
(1)该混合液中含溶质NaCl的物质的量为_________mol,含溶质MgCl2的质量为__________g。
(2)该混合液中含溶质MgCl2的物质的量为____________,将该混合液加水稀释至体积为1L,稀释后溶液中Ba2+的物质的量浓度为_________mol/L
(3)若向该混合液溶液中通入NH3使Mg2+完全沉淀,需要标况下NH3_____________L。
已知MgCl2+2NH3=Mg(OH)2↓+2NH4Cl
【答案】
(1)0.2;9.5;
(2)0.1;0.1;
(3)4.48。
【解析】
试题分析:由题图可知,n(Na+)=0.2L×1.0mol/L=0.2 mol,n(Mg2+)=0.2L×0.5mol/L =0.1 mol,n(Cl-)= 0.2L×3.0mol/L =0.6 mol。
(1)n(NaCl)= n(Na+)=0.2 mol,n(MgCl2)= n(Mg2+)=0.1 mol,m(MgCl2)=0.1 mol×95 gmol-1=9.5 g,故答案为:0.2;9.5;
(2)n(MgCl2)= n(Mg2+)=0.1 mol,BaCl2提供的n(Cl-)=0.6 mol-0.2 mol-0.1 mol×2=0.2 mol,则n(BaCl2)=0.1 mol,c(BaCl2)=![]() =0.1 molL-1,溶液中Ba2+ 的物质的量浓度为0.1mol/L,故答案为:0.1;0.1;
=0.1 molL-1,溶液中Ba2+ 的物质的量浓度为0.1mol/L,故答案为:0.1;0.1;
(3)n(Mg2+)=0.1 mol,MgCl2+2 NH3=Mg(OH)2↓+2NH4Cl,需要n(NH3)=0.1mol×2=0.2mol,标况下的体积为0.2mol×22.4L/mol=4.48L,故答案为:4.48。