题目内容
下列实验方案的设计不可行的是( )
| A.用铜和稀硝酸反应制取NO,并用向上排空气法收集气体 |
| B.制备Fe(OH)2时,应将胶头滴管伸入氢氧化钠溶液中再滴入FeSO4溶液 |
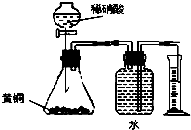
| C.用如图所示的装置测定黄铜(Cu、Zn合金)中Zn的含量 |
| D.除去粗盐中的Ca2+、Mg2+、SO42-,依次加入的物质是H2O、Ba(OH)2、Na2CO3、HCl |

A.一氧化氮的密度接近空气的密度,且一氧化氮极易与空气中的氧气反应生成二氧化氮,所以不能用排空气法收集,故A错误;
B.为了防止空气中氧气氧化氢氧化亚铁,制备Fe(OH)2操作中的胶头滴管下端需插入氢氧化钠溶液中再滴入FeSO4溶液,故B正确;
C.黄铜中的铜不能和稀硫酸反应,发生反应的为锌和稀硫酸,Zn+H2SO4═ZnSO4+H2↑,用排水集气法收集氢气时,瓶内先装满水,氢气难溶于水,排出的水的体积为生成氢气的体积,根据氢气的物质的量求出锌的质量,可用所示的装置测定黄铜(Cu、Zn合金)中Zn的含量,故C正确;
D.须先除SO42-,然后再除Ca2+,Na2CO3可以除去过量的Ba2+,否则过量的Ba2+不能完全除尽,至于加NaOH除去Mg2+顺序不受限制,可放在加入BaCl2之前或之后,因为过量的NaOH加HCl就可以调节,只要将三种离子完全除去,过滤即可,最后加HCl除去过量的氢氧根离子碳酸根离子,所以除去粗盐中的Ca2+、Mg2+、SO42-,依次加入的物质是H2O、Ba(OH)2、Na2CO3、HCl,故D正确;
故选A.
B.为了防止空气中氧气氧化氢氧化亚铁,制备Fe(OH)2操作中的胶头滴管下端需插入氢氧化钠溶液中再滴入FeSO4溶液,故B正确;
C.黄铜中的铜不能和稀硫酸反应,发生反应的为锌和稀硫酸,Zn+H2SO4═ZnSO4+H2↑,用排水集气法收集氢气时,瓶内先装满水,氢气难溶于水,排出的水的体积为生成氢气的体积,根据氢气的物质的量求出锌的质量,可用所示的装置测定黄铜(Cu、Zn合金)中Zn的含量,故C正确;
D.须先除SO42-,然后再除Ca2+,Na2CO3可以除去过量的Ba2+,否则过量的Ba2+不能完全除尽,至于加NaOH除去Mg2+顺序不受限制,可放在加入BaCl2之前或之后,因为过量的NaOH加HCl就可以调节,只要将三种离子完全除去,过滤即可,最后加HCl除去过量的氢氧根离子碳酸根离子,所以除去粗盐中的Ca2+、Mg2+、SO42-,依次加入的物质是H2O、Ba(OH)2、Na2CO3、HCl,故D正确;
故选A.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案
相关题目
 下列实验方案的设计不可行的是( )
下列实验方案的设计不可行的是( )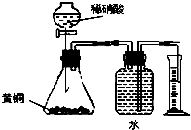 下列实验方案的设计不可行的是
下列实验方案的设计不可行的是