题目内容
【题目】如下图所示,A、B两个装置中两个烧杯分别盛有足量的CuSO4溶液:
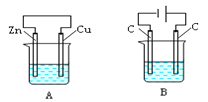
(1)A、B两个装置中属于原电池的是_____(填标号,下同),属于电解池的是____。
(2)A池中Zn是___极,发生______(填氧化或还原)反应,电极反应式为____________; Cu极电极反应式为_______;A中总反应的离子方程式为__________。
(3)B池中左边C是___极,发生______(填氧化或还原)反应,电极反应式____________;右边C极电极反应式为_________;B中总反应的化学方程式为_______。
【答案】A B 负 氧化 Zn-2e- = Zn2+ Cu2++2e- = Cu Zn +Cu2+= Zn2++Cu 阴 还原 2Cu2++4e- = 2Cu 4OH- -4e-=2H2O+O2↑ 2CuSO4+2H2O![]() 2Cu+2H2SO4+O2↑
2Cu+2H2SO4+O2↑
【解析】
(1)原电池和电解池的明显区别是电解池有外接直流电源,所以B属于电解池,A属于原电池。
(2)A池是原电池,锌比铜活泼,所以Zn是负极,发生氧化反应,电极反应式为Zn-2e- = Zn2+;Cu为正极,电极反应式为Cu2++2e- = Cu;A中总反应的离子方程式为Zn +Cu2+= Zn2++Cu。
(3)B池是电解池,左边C和电源负极相连,是阴极,发生还原反应,电极反应式为2Cu2++4e- = 2Cu;右边C极是阳极,电极反应式为4OH- -4e-=2H2O+O2↑;B中总反应的化学方程式为2CuSO4+2H2O![]() 2Cu+2H2SO4+O2↑。
2Cu+2H2SO4+O2↑。

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案
相关题目