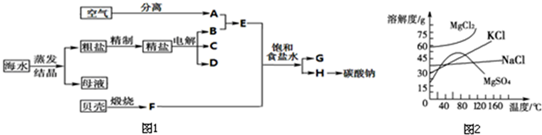
��Ŀ����
1����֪A��B��CΪ��ѧ��ѧ�г����ĵ��ʣ������£�AΪ���壬BΪ����ɫ���壬CΪ�ܶ���С�����壮�����˵������£����ǿ�����ͼ���з�Ӧ���ش��������⣺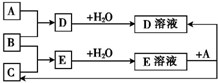
��1��E�Ļ�ѧʽΪHCl��
��2��A��B��C����Ԫ������һ���ǽ�����������Ԫ����A���A����B����C�����������ǽ��������������²�����̬���ʣ�
��3��A��B��C����Ԫ���е���������Ԫ���γɵĻ����������������һ�����Ǣڢۣ�
���⻯��ڼ����������Σ�
���� ��֪A��B��CΪ��ѧ��ѧ�г����ĵ��ʣ������£�AΪ���壬BΪ����ɫ���壬��BΪCl2��CΪ�ܶ���С�����壬��CΪH2������EΪHCl��E��Һ����A��Ӧ��������������AӦΪ������DΪ����A�����ᷴӦ���ɵ��Ȼ����Σ����ο���ֱ����A��Cl2��Ӧ�õ���˵����Aһ�����DZ�۽�������A�����Ƕ��۽����ơ�þ�����ȣ�Ȼ�������ʵ����ʼ���ѧ���������
��� �⣺��֪A��B��CΪ��ѧ��ѧ�г����ĵ��ʣ������£�AΪ���壬BΪ����ɫ���壬��BΪCl2��CΪ�ܶ���С�����壬��CΪH2������EΪHCl��E��Һ����A��Ӧ��������������AӦΪ������DΪ����A�����ᷴӦ���ɵ��Ȼ����Σ����ο���ֱ����A��Cl2��Ӧ�õ���˵����Aһ�����DZ�۽�������A�����Ƕ��۽����ơ�þ�����ȣ�
��1��������������֪��E�Ļ�ѧʽΪHCl��
�ʴ�Ϊ��HCl��
��2��A��B��C����Ԫ������һ���ǽ�����������Ԫ���п����ǽ�������A������������������²�����̬���ʣ�
�ʴ�Ϊ��A�����������������²�����̬���ʣ�
��3��AΪ������BΪ������CΪ����������Ԫ���е����������γɵĻ����������������Ϊ�ᡢ�Ρ��⻯�һ�����Ǽ���������Ԫ�أ�
�ʴ�Ϊ���ڢۣ�
���� ���⿼��������ƶϣ�Ϊ��Ƶ���㣬���鳣�����ʻ�ѧ���ʼ����ת����ϵ�����ۺϳ̶Ƚϴ�˼ά�ռ�Ϲ㣬��Ŀ�Ѷ��еȣ�ͻ�ƿڲ���ʮ�����ԣ����������龳�У���֤�ƶ�ͻ�Ƴ�Ϊ�ϲߣ���Ŀ�Ѷ��еȣ�

| A�� | �Թ�������������ȵĴ�����Һϴ��������ˮ��ϴ | |
| B�� | �Ȱ��Թ���ķ�Һ������ˮ���У�������ˮ��ϴ | |
| C�� | �������������������Թܣ������ռ��ܽ⣬������ˮ��ϴ | |
| D�� | ʢ��ʯ��ˮ������¹������ʵ��ձ������÷���ˮϴ��������ˮ��ϴ |
��HF��aq��+OH- ��aq��=F- ��aq��+H2O��l����H=-67.7KJ•mol-1
��H+��aq��+OH- ��aq��=H2O��l����H=-57.3KJ•mol-1
��20mL0.1•molL-1������м���VmL0.1mol•L-1NaOH��Һ�������й�˵����ȷ���ǣ�������
| A�� | �����ĵ��뷽��ʽ����ЧӦ�ɱ�ʾΪ��HF��aq��?H+��aq��+F-��aq����H=+10.4 KJ•mol-1 | |
| B�� | ��V=20ʱ����Һ�У�c��F-����c��Na+��=0.1 mol?L-1 | |
| C�� | ��V=20ʱ����Һ�У�c��Na+����c��F-����c��OH-����c��H+�� | |
| D�� | ��V��0ʱ����Һ��һ�����ڣ�c��Na+����c��F-����c��OH-����c��H+�� |
| A�� | ��A������CH3COOH | B�� | ��A������H2SO4 | ||
| C�� | ��B������Ba��OH��2 | D�� | ��B������CH3CH2OH |
| ʱ�䣨min�� | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| n��A�� | 2.00 | 1.90 | 1.82 | 1.76 | 1.64 | 1.54 | 1.50 | 1.50 | 1.50 |
| n��B�� | 1.00 | 0.95 | 0.91 | 0.88 | 0.82 | 0.77 | 0.75 | 0.75 | 0.75 |
| n��C�� | 0 | 0.10 | 0.18 | 0.24 | 0.36 | 0.46 | 0.50 | 0.50 | 0.50 |
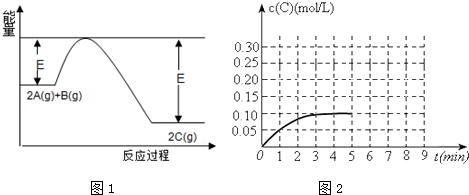
�ش��������⣺
��1����Ӧ������Ӧ��H��������ڡ���С�ڡ���0��
��2���÷�Ӧ�ﵽƽ��ʱ������˵������ȷ����D��
��A��������ܶȲ��ٸı� ��B��A�����ʵ���Ũ�Ȳ��ٸı�
��C���ų������յ��������ٱ仯 ��D��v����A��=v����A��=0
��3��t��Cʱ����һ�ݻ�Ϊ2L�ĺ����ܱ������ڼ���0.4molA��0.6molB����һ�������·�����Ӧ����Ӧ��C�����ʵ���Ũ�ȱ仯�����2ͼ�����¶��£���Ӧ���е�1����ʱB���ʵ���Ϊ0.55mol��
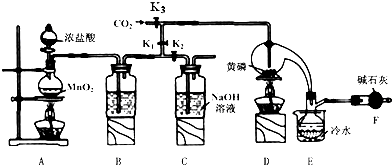
��֪����������Cl2��Ӧ����PCl3�������Cl2��Ӧ����PCl5��PCl3��ˮ��ǿ��ˮ������H3PO3��HCl����O2������POCl3��POCl3����PCl3��PCl3��POCl3���۷е������
| ���� | �۵�/�� | �е�/�� |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
��1��B����װ�Լ���ŨH2SO4��E����ˮ������������PCl3��ֹ��ӷ���
��2��F�м�ʯ�ҵ����������ն������������ֹ�����е�ˮ����������ƿ�к�PCl3 ��Ӧ��
��3��ʵ��ʱ�����װ�������Ժ��ȴ�K3ͨ������CO2����Ѹ�ټ�����ף�ͨ����CO2���������ž�װ���еĿ�������ֹ������ȼ��
��4���ֲ�Ʒ�г�����POC13��PCl5�ȣ���������ȳ�ȥPCl5��ͨ��������ʵ��������ƣ������ɵõ��ϴ�����PCl3��
��5��ʵ�����ʱ����������C�е��Լ����ն����������C�з�Ӧ�����ӷ���ʽΪCl2+2OH-=Cl-+ClO-+2H2O��
��6��ͨ�����淽���ɲⶨ��Ʒ��PCl3������������
��Ѹ�ٳ�ȡ1.00g��Ʒ����ˮ��Ӧ�����250mL��Һ��
��ȡ������Һ25.00mL�������м���10.00mL 0.1000mol/L��ˮ����ַ�Ӧ��
�����������Һ�м��뼸�ε�����Һ����0.1000mol/L��Na2S2O3����Һ�ζ���
���ظ��ڡ��۲�����ƽ������Na2S2O3��Һ8.40mL��
��֪��H3PO3+I2=H3PO4+2HI��I2+2Na2S2O3=2NaI+Na2S4O6��
�����������ݣ�����ⶨ������û��������Ӧ���ò�Ʒ��PCl3����������Ϊ79.75%��
| A�� | ���� | B�� | Cl2 | C�� | NH4NO3 | D�� | NH3 |
 ���÷���������Ҫ�ɷ�ΪAl��������Fe��Si�ȣ��ȿ���ȡ�л��ϳɴ���AlBr3�ֿ���ȡ��ˮ������������[A12��SO4��3•18H2O]��
���÷���������Ҫ�ɷ�ΪAl��������Fe��Si�ȣ��ȿ���ȡ�л��ϳɴ���AlBr3�ֿ���ȡ��ˮ������������[A12��SO4��3•18H2O]��