题目内容
(10分)下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用相应化学用语回答下
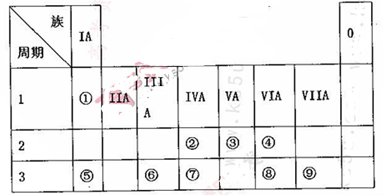
列问题:
(1)画出表中形成化合物种类最多元素的原子结构示意图____;写出它与原予半径最小的原子形成10电子且为正四面体结构的化合物的电子式____,用电子式表示⑤和⑧形成化合物的过程________。
(2).④⑤⑧形成的简单离子半径由大到小的顺序为____(填离子符号);③⑦⑨的最高价氧化物对应水化物的酸性由强到弱的顺序为_______(填化学式)。
(3).⑤和⑨形成化合物的化学键为__________。
(4).这些元素形成的氧化物中,不溶于水,但既能与强酸又能与强碱反应的是_______(填化学式),写出它与⑤的最高价氧化物对应水化物发生反应的离子方程式___________________________。

列问题:
(1)画出表中形成化合物种类最多元素的原子结构示意图____;写出它与原予半径最小的原子形成10电子且为正四面体结构的化合物的电子式____,用电子式表示⑤和⑧形成化合物的过程________。
(2).④⑤⑧形成的简单离子半径由大到小的顺序为____(填离子符号);③⑦⑨的最高价氧化物对应水化物的酸性由强到弱的顺序为_______(填化学式)。
(3).⑤和⑨形成化合物的化学键为__________。
(4).这些元素形成的氧化物中,不溶于水,但既能与强酸又能与强碱反应的是_______(填化学式),写出它与⑤的最高价氧化物对应水化物发生反应的离子方程式___________________________。
(1)碳的原子结构示意图是 ;甲烷的电子式
;甲烷的电子式 ;
; ;
;
(2)S2->O2->Na+;HClO4>HNO3>H2SiO3
(3)离子键
(4)Al2O3;Al2O3+2OH-=2AlO-2+H2O
 ;甲烷的电子式
;甲烷的电子式 ;
; ;
;(2)S2->O2->Na+;HClO4>HNO3>H2SiO3
(3)离子键
(4)Al2O3;Al2O3+2OH-=2AlO-2+H2O
试题分析:(1)表中形成化合物种类最多元素是③号元素C,核电荷数是6,原子结构示意图是
 ;原子半径最小的是①号H元素,C与H形成的10电子的化合物是甲烷,其电子式为
;原子半径最小的是①号H元素,C与H形成的10电子的化合物是甲烷,其电子式为 ;⑤⑧分别是Na、S元素,二者形成离子化合物Na2S,用电子式表示形成过程如下:
;⑤⑧分别是Na、S元素,二者形成离子化合物Na2S,用电子式表示形成过程如下: ;
;(2)④⑤⑧形成的简单离子分别是O2-、Na+、S2-,S2-的电子层数最多,半径最大,O2-、Na+的电子层数相同,核电荷数越多半径越小,所以Na+的半径最小;根据元素非金属性的强弱,N、Si、Cl的最高价含氧酸的强弱顺序是HClO4>HNO3>H2SiO3
(3)⑤和⑨形成化合物是NaCl,含有离子键;
(4)这些元素形成的氧化物中,不溶于水,但既能与强酸又能与强碱反应的是Al2O3;⑤的最高价氧化物对应水化物是NaOH,氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,离子方程式为Al2O3+2OH-=2AlO-2+H2O。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 ②
② ;③
;③ 。则下列有关这三种原子的叙述中正确的是
。则下列有关这三种原子的叙述中正确的是